а) Благодаря эффекту гиперконъюгации:
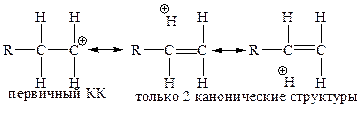
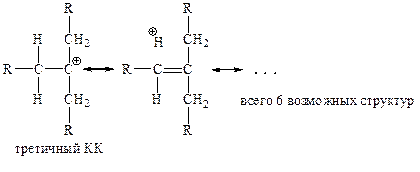
б) Стабилизация за счет донорного эффекта алкильной группы, +I(+F)-эффект:
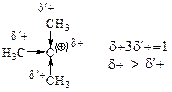
За счет +I-эффекта метильных групп величина положительного заряда на центральном углероде (на карбокатионном центре) уменьшается, и он частично оттягивается (делокализуется) на a-углероды метильных групп; а известно, что заряженная частица тем устойчивее, чем больше делокализован заряд.
Среди простых алкильных катионов наиболее устойчивы трет-бутильные катионы. Все известные алкилкатионы, содержащие не менее 4 углеродов, при нагревании дают трет-бутилкатион:
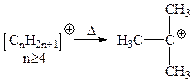
Этот катион генерируется в суперкислотах также из низших алканов и даже из парафина и полиэтилена:
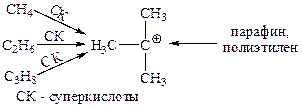
Полученные из растворов суперкислот твердые соли трет-бутил- и трет-пентилкатионов устойчивы при температурах ниже -20°C.
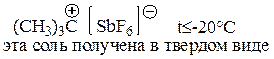
в) Резонансная (мезомерная) стабилизация:
(i)
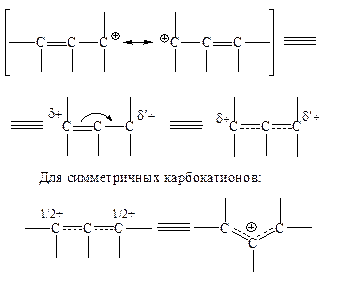
(ii)
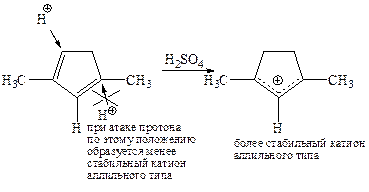
Положение протонирования доказано с помощью спектроскопии ЯМР.
(iii) Дивинилметил-катионы более устойчивы, чем простые катионы аллильного типа. Важным примером такого типа частиц являются аренониевые ионы – высокореакционноспособные интермедиаты в реакциях ароматического электрофильного замещения (так называемые s-комплексы):
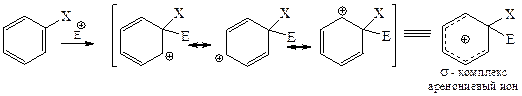
Тривинилметилкатионы с открытой цепью устойчивы при низких температурах (-55°C) во фторсульфонофой кислоте.
(iv) Бензильные катионы также стабилизируются резонансом:
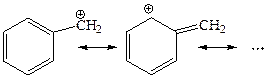
Ряд бензильных катионов получен в виде солей с SbF6y. Еще более устойчивы диарил метил- и триарилметилкатионы Ar2HCÅ и Ar3CÅ:
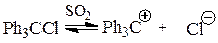
Они были выделены в виде твердых солей, а их тетрафторбораты являются продажными реактивами:
Электронодонорные заместители в орто- и пара-положениях повышают устойчивость арилметильных катионов.
(v) Циклопропилметилкатионы еще более устойчивы, чем катионы бензильного типа:
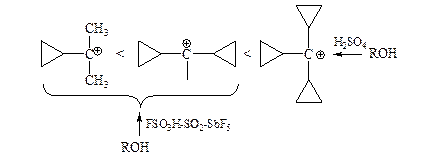
Такая устойчивость объясняется сопряжением между изогнутыми («банановыми») орбиталями циклопропильных колец, имеющими промежуточный s-p-характер, и вакантной р-орбиталью катионного центра:
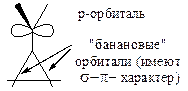
(vi) Стабилизация за счет гетероатома с неподеленной электронной парой (O, S, N, Hal) в соседнем положении к карбокатионному центру:
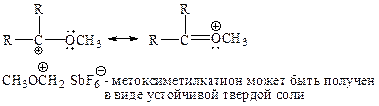
(vii) Ацильные катионы
Простые ацильные катионы RCOÅ были получены и в растворе, и в твердом состоянии. Ацетилкатион устойчив почти также, как и трет-бутилкатион. Хотя положительный заряд сосредоточен в основном на углероде, ацильные катионы дополнительно стабилизируются за счет вклада канонической структуры с тройной связью:

Особой стабильностью обладают 2,4,6-триметил- и 2,3,4,5,6-пентаметил-бензоильные катионы (по стерическим причинам, очевидно, способствующим выходу кольца из сопряжения с карбонилом и входу в сопряжение с вакантной р-орбиталью), легко образующиеся в 96%-ной серной кислоте:
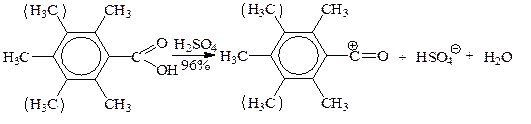
(viii) В большинстве других случаев стабильность карбокатионов может быть также объяснена резонансом (тропилиевый катион, циклопропенильный и другие ароматические катионы). Если резонансная стабилизация отсутствует, то карбокатион является очень нестабильным (короткоживущим) или вообще не образуется: ни винильный, ни фенильный катионы не были получены в виде относительно устойчивых частиц в растворах:
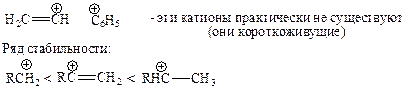
ОЦЕНКА ОТНОСИТЕЛЬНОЙ УСТОЙЧИВОСТИ КАРБОКАТИОНОВ (НА ПРИМЕРЕ ОТНОСИТЕЛЬНО УСТОЙЧИВЫХ КАРБОКАТИОНОВ, ОБРАЗУЮЩИХСЯ ПРИ ИОНИЗАЦИИ СПИРТОВ В КИСЛЫХ РАСТВОРАХ)
1. Для оценки стабильности относительно стабильных КК используют метод определения величины рKR+:
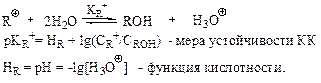
При концентрации серной кислоты больше, чем 5%, pH уходит в отрицательные значения, и концентрацию протонов нельзя измерить обычными инструментальными способами. Функцию кислотности HR нельзя измерить инструментально. Существуют таблицы значений HR как функции концентрации серной кислоты. Обычно величину HR рассчитывают на основе экспериментальных данных по протонированию специального набора индикаторов в сильнокислых средах.
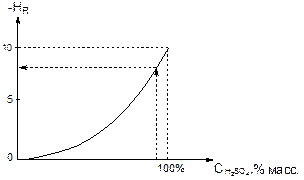
Рисунок 1
Чтобы получить рKR+ для катиона R+, спирт ROH растворяют в кислоте с известной величиной HR. Отношение CR+/CROH находят каким-либо подходящим способом, обычно спектрофотометрическим.
2. Для оценки относительной стабильности очень нестабильных простых карбокатионов используют метод ион-циклотронного резонанса, измеряя энергии диссоциации связи R-Br в алкилгалогенидах с образованием RÅ и Bry в газовой фазе.
| ион | DR-Br, ккал/моль |
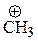 | 218 |
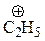 | 182 |
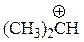 | 163 |
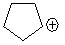 | 161 |
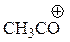 | 151 |
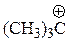 | 149 |
Поскольку в трехкоординированных карбокатионах у центрального углерода только три связи и нет других валентных электронов, то эти связи имеют sp2-гибридизацию и должны находиться в одной плоскости, что подтверждается спектральными данными для простых карбокатионов, а также необразованием карбокатионного центра в голове мостиковых систем, так как в этом случае три связи углерода не могут лежать в одной плоскости. Исключением является почти плоский адамантилкатион:
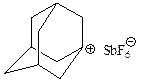
Несмотря на возможный выигрыш в энергии резонанса, триарилкатионы из-за стерических затруднений для нахождения всех трех бензольных колец в одной плоскости имеют форму пропеллера:
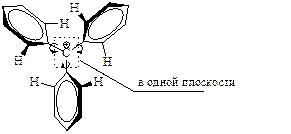
Важным методом изучения строения КК является измерение химических сдвигов положительно заряженного углерода в спектрах ЯМР 13С в сверхкислых средах: между химсдвигом и электронной плотностью (положительным зарядом) на карбокатионном центре имеется неплохая корреляция.
 2014-02-02
2014-02-02 11230
11230








