Вопрос 3.
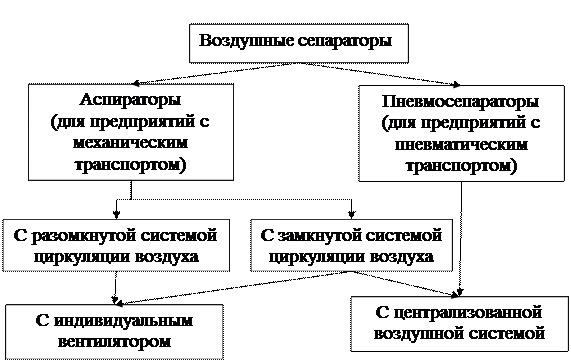
Воздушные сепараторы, используемые на перерабатывающих предприятиях можно классифицировать по следующим признакам (рис. 4):
Рисунок 4 – Классификация воздушных сепараторов
Воздушный сепаратор с разомкнутым циклом работы состоит из аспирационного канала 1, осадочной камеры 2 и вентилятора 4. За счет разряжения создаваемого вентилятором, воздух поступает в аспирационный канал и отделяет от зерна легкие примеси. Далее воздух и легкие примеси поступают в осадочную камеру. Легкие примеси осаждаются, а воздух поступает в аспирационную систему завода. Скорость воздушного потока регулируется заслонкой 5.
Особенностью работы аспираторов с разомкнутым циклом в том, что в технологическом процессе постоянно используется новый (свежий) воздух из помещения. Отработанный воздух пройдет через очистные сооружения (циклоны, фильтры) завода, выбрасывается в атмосферу.
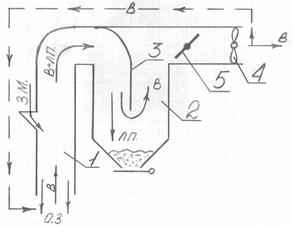
Рисунок 5 – Схема воздушного сепаратора
В воздушных сепараторах с замкнутым циклом воздух, очищенный в осадочной камере, по специальным каналам вновь направляется на очистку зерна.
Данные сепараторы находят все большее применение на перерабатывающих заводах, т.к. не требуют дополнительных коммуникаций. Однако есть один недостаток. Используемый воздух, даже если его пропустить через фильтр, полностью очистить нельзя, поэтому при установившемся режиме в нем содержится определенная концентрация пыли, что снижает эффективность очистки на 10…20%.
Очистка воздуха в осадочной камере осуществляется за счет трех факторов:
1. За счет увеличения площади поперечного сечения воздушного канала в осадочной камере.
Объем воздуха проходящего через воздушный сепаратор есть величина постоянная и определяется по формуле:
Q=F υ, (м3/с) (5)
где, F – площадь поперечного сечения канала, м2;
υ – скорость воздушного потока, м/с.
Соответственно можно записать:
Q=Fак υак = Fок υок→ υок = 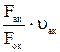 (6)
(6)
 где, Fак - площадь поперечного сечения аспирационного канала, м2;
где, Fак - площадь поперечного сечения аспирационного канала, м2;
Fок - площадь поперечного сечения осадочной камеры, м2;
υак – скорость воздуха в аспирационном канале, м/с;
υок - скорость воздуха в осадочной камере, м/с;
Следовательно, во сколько раз сечение осадочной камеры больше сечения аспирационного канала, во столько раз скорость воздуха в осадочной камере меньше скорости воздуха в аспирационном канале. Соответственно снижается сила сопротивления воздушному потоку и примеси оседают. Сечение осадочной камеры применяют таким, чтобы скорость воздуха находилась в пределах 0,5…0,7м/с.
2. Канал на входе в осадочную камеру имеет загнутый козырек 3 (рис.5), в результате этого легкие примеси движутся по окружности. В этом случае на частицу действует центробежная сила Fц = 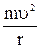 (r – радиус загиба козырька), которая прижимает примеси к стенке камеры, в результате трения они дополнительно теряют скорость и оседают.
(r – радиус загиба козырька), которая прижимает примеси к стенке камеры, в результате трения они дополнительно теряют скорость и оседают.
3. Канал в осадочной камере за счет козырька резко изменяет направление воздушного потока. В результате этого частица, обладающая определенной массой, за счет сил инерции Fи = ma продолжает двигаться по прямой и выходит из воздушного потока.
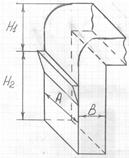 |
Аспирационный канал (рис. 6) характеризуется длинной А, шириной В, высотой Н1 от места поступления зерна в канал до поворота в осадочное устройство и высотой Н2 от места поступления воздуха в канал до места поступления зерна.
Рисунок 6 – Схема аспирационного канала
Производительность воздушного сепаратора зависит от длинны аспирационного канала и допустимой удельной зерновой нагрузки на 1 см длины канала.
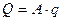 , (кг/ч) (7)
, (кг/ч) (7)
где, Q – производительность, кг/ч;
А – длина канала, см;
q – удельная зерновая нагрузка на 1 см длины канала, кг/(см·час).
С увеличением удельной зерновой нагрузки эффективность очистки снижается. В производственных условиях? наилучший эффект обеспечивается при q =85…110 кг/(см·час).
Эффективность очистки сепараторов определяется по формуле:
Е = 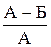 (100-а), (%) (8)
(100-а), (%) (8)
где, А – количество примесей в исходном зерне, кг;
Б – количество примесей в зерне после очистки, кг;
а – количество полноценного зерна в отходах, %.
При проектировании зерноперерабатывающих предприятий расчет воздушных сепараторов заключается в выборе их количества по формуле:
N=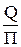 , (шт) (9)
, (шт) (9)
где, Q - количество зерновой массы, подвергаемую отчистке, кг/ч
П – паспортная производительность сепаратора на данном виде продукта, кг/ч.
Итак, нкРНК регулируют транскрипцию при обслуживании общеклеточных функций.
Энхансеры тоже транскрибируются. И в элонгации их транскрипции тоже участвуют нкРНК.
Еще раз действие нкРНК:
1. воздействие молекулы нк РНК (взаимодействия с белками и комплементарные взаимодействия, аллостерические эффекты белков и самих нкРНК)
2. роль акта транскрипции нкРНК, модифицирующего хроматин (хроматин не остается безучатсным к действию полимеразы и привлекает какие-то комплексы)
Регуляция гена, кодирующего дегидрофолатдегидрогеназу DHFR (синтез тетрагидрофолата, который отвечает за перенос метильной группы с образованием тимина, то есть за синтез ДНК). С промотора (ниже него кодирующая зона) синтезируется РНК (у нее есть определенная структура, не показанная на рисунке), которая связывается с базальным фактором транскрипции TFIIB и меняет его конформацию так, что он уже не может связаться с промотором для синтеза мРНК DHFR. Эта промоторная РНК может образовывать триплекс с ДНК (показано in vitro) (триплексные структуры ДНК могут существовать при определенных структурных правилах – участвуют не только Уотсон-Криковские взаимодействия, но и Хугстеновские), и тут так меняется промоторная структура, что работает уже совсем не как обычно. Много попыток in vivo для блокировки нужного гена – искусственно создают соответственные триплексы для промоторных участков, и чаще всего удается подавить экспрессию гена.

У нас в DHFR образование триплекса через большую бороздку ДНК (одна цепь должна быть полипуриновой, другая полипиримидиновой):

Для изучения триплексов готовили АТ к триплексам, обработали ими человеческие клетки и увидели довольно много участков, которые как будто бы образовали такие триплексные структуры. Затем биоинформатические исследования были проведены, чтобы понять, где может образовываться триплекс, а где нет.

Еще раз – РНК-полимераза2 привлекает за счет своего CTD целый ряд белков, модифицирующих хроматин, в том числе лизинметилтрансферазы, в том числе метилирующая 4ый лизин с N-конца гистона Н3 (Н3К4me3 - полученная активная метка). Полимераза также привлекает комплексы ремоделинга хроматина (множество таких комплексов, самый простой – в комплексе есть субъединица, функционирующая с участием АТФ, изменяется конформация и осуществляется скольжение нуклеосомы относительно ДНК.


Участок становится доступен для транскрипционных факторов и изменяется его способность к транскрипции.
Энхансеры и нкРНК.
Существует глубокое непонимание механизмов их действия. Энхансерные последовательности, которые часто находятся в генных пустынях (свободны от генов, кодирующих белки) активно транскрибируются и находят РНК – eRNA. Явно для чего-то нужны.

На картинке – общая картина работы всего при транскрипции. Наверное, нам стоит повторить активаторныый и медиаторный комплексы))
Медиатор – взаимодействие между промотором и энхансером. Сложный комплекс. В медиаторе много субъединиц, которые взаимодействуют с эффекторными молекулами, меняющими конформацию субъединиц и всего комплекса в целом.
Цис-действующие элементы (еще раз повторим): элемент, который находится рядом с тем геном или в той же молекуле ДНК. Если энхансер далеко, но в той же хромосоме, то он цис-дейтвующий. А белки, которые синтезировались на других хромосомах – транс-действующие.
Энхансер тоже может быть транс-действующим.
Подробнее медиатор. Здесь не обозначена нкРНК, но зато показана новообразованная РНК.

Сближению промотора и энхансера соответствует привлечение когезина (комплекса белков, которые образуют кольцо). Нужны для репарации, гомологичной рекомбинации (в случае оепарации) и тд.

Энхансеры очень разные по своим функциям и по отношению к определенному гену. Самые интересные рассмотрим. От нейробиологов узнали, что энхансеры транскрибируются. И еще энхансеры стволовых клеток интересны.
Интересны гены, которые активируются при дифференцировке нейронов. Тут показан ген, кодирующий фактор транскрипции – Dlx6. Этот фактор узнает другой важный ген, необходимый для дифференцировки нервных клеток. Evf2 – очень консервативный участок для млекопитающих (консервативен по нуклеотидной последовательности), который дает нкРНК, соединяющуюся с фактором транскрипции, который актвирует транскрипцию гена (наверное, он имел в виду, что происходит активация гена Dlx6, а фактор транскрипции – Dlx2, но я не уверена).

Хроматин в энхансере и промотере различается по модификации гистонов. H3K4me3 – активная метка промотора (привлекает к себе целый ряд комплексов, способствующих транскрипции). H3K4me1 – маркер хроматина энхансеров, эмбриональных стволовых клеток (ЭСТ, ESC) (не только), кто ее узнает, мы не знаем. Деметилирование Н3К4me1 сопровождается их дифференцировкой. Энхансер определяет прюрипотентность стволовой клетки, а после деметилирования наступает дифференцировка.

Механизм действия энхансера точно неизвестен. Только ясно, что есть сближение. И транскрипция энхансера тоже есть. Для некоторых энхансеров показано образование участка активного хроматина - особая структура домена (2-4 тнп) активного хроматина, (Н3К4me1, а не промоторная модификация - Н3К4me3). В центре домена - коактиватор СВР c активностью гистонацетилтрансферазы, и в этом случае в хроматине энхансера уже ацетилирование 27ого лизина с N-конца (Н3К27ас). И эти две метки – характеристики актвиного энхансера.
Еще также удивительно, что для активации энхансера нужна его транскрипция, а для ее осуществления, он должен иметь мишень.
Еще интересно, что разные клетки (дифференцировка разная) отличаются больше всего не промотерами, а энхансерами.
Согласованное действие энхансера (желтый) и промотора (синий). Для активации транскрипции – сближение. Это сближение зависит от того, что идет транскрипция. Это все перемещается в пространстве ядра и попадает в транскрипционную фабрику (компартмент, в котором сближены участки хромосом, где идет транскрипция). Транскрипция энхансера тогда, когда он соединяется с промотором.

Объединение разных хромосом в пространстве ядра определяется нкРНК (позже об этом поговорим).
Теперь отношение нкРНК к принципу действия гормонов.
• Есть белок-рецептор взаимодействует в цитоплазме с лигандом – гормоном (эстрогеном, тиреоидным гормоном и др.)
• Гормон-рецепторный комплекс в ядре находит в промотере/энхансере сиквенс-специфичные сайты связывания, выступая как репрессор или активатор.
ER – рецептор эстрогена, X – эстроген, Sp1 – фактор транскрипции. SRA, steroid RNA activator (600 нуклеотидов) - нкРНК, аллостерические взаимодействия с рецептором (ER). Она подвергается модификации (уридин превращается в псевдоуридин). Кроме того, эта РНК имеет разные формы альтернативного сплайсинга (некоторые формы транслируются частично, а некоторые – чисто некодирующая.
SRA-привлечение белков, модифицирующих хроматин.

Стали проводить исследования этой нкРНК. Стало ясно, что она может принимать определенные структуры (спаренная, шпильки и тд), с которыми взаимодействуют РНК-шапероны и РНК-хеликазы. В том числе в состав взаимодействующих комплесов входит комплекс CTCF (выполняет инсуляторную функцию. Но лучше сказать более общо – взаимодействует с определенными удаленными участками ДНК и сближает их друг с другом). И эта РНК, видимо, участвует в этих процессах.

Эта некодирующая РНК функционирует также с рецепторами ретиноевой кислоты, тиреоидного гормона, витамина D и с фактором транскрипции MyoD, запускающим дифференцировку мышц.
Есть какие-то дискретные структуры этой нкРНК – стебель/петля - основа для осуществления коактиваторной (SRA РНК) или репрессорной (7SK РНК) активности (могут быть и для той, и для той функции).
Некодирующая 7SK РНК.
Довольно давно было известно, что в клетке есть 7SL РНК и она участвует в образовании частиц, которые нужны для узнавания мРНК, которая кодирует секретируемые белки. А вот для чего 7SK было довольно долго неясно зачем. Ее тоже очень много. А оказалось, что она нужна для того, чтобы препятствовать элонгации транскрипции. В общем коротко все так: транскрипционный пузырь, садится РНК-полимераза, дальше абортивная транскрипция (РНК-полимераза пытается уйти с места посадки), продуктивная элонгация – достаточно длинный фрагмент транскрибировался.
Большей частью регуляция осуществляется не за счет посадки, а за счет обеспечить/препятствовать элонгации транскрипции (то есть транскрипция начинается не тогда, когда села полимераза). В этом есть определенна выгода – когда она уже села, то для запуска продуктивной элонгации уже не надо ее привлекать. Для ее запуска нужен позитивный транскрипционный фактор элонгации pTEF, который работает в комплексе с циклин-зависимой киназой (фосфорилирует свою мишень) и циклином. Комплекс активен – фосфорилирование C-терминального домена большой субъединицы РНК-полимеразы. Когда начинается абортивная транскрипция – тоже определенный комплекс киназы с циклинами, который фосфорилирует этот хвост. Когда она осуществилась – фосфорилирован 5ый. А для продуктивной элонгации должен быть фосфорилирован 2ой. Вот наш комплекс (pTEF и друзья) и фосфорилирует 2ой, если с ним не связан 7SK (330 нуклеотидов мешают нашему комплексу работать).

В общем, очень много осуществляется на стадии элонгации.
Что из себя представляет 7SK?
Чисто программой ее укладывали. Вот, что вышло:

С этой 7SK РНК взаимодействуют многие другие белки. Скажем, белки, которые определяют клеточные деления (в том числе супрессоры опухолей – определяют ее конформацию, и, следовательно, ее способность инактивировать наш комплекс). Стволики и петли – главные для образования платформы для связывания белков.
Значит, еще раз. 7SK препятствует фосфорилированию нужной позиции в хвосте РНК-полимеразы:

Внутриядерные структуры и нкРНК.
нк РНК:
1.платформа для образования структуры
2. комплекс с белком, меняющим его конформацию и функциональные свойства
На картинке видна мембрана, ядерные поры, ДНК, ядрышко.
Ядрышко – синтез рРНК и сборка рибосом, но это не все – там несколько тысяч разных белков, из них 30% в синтезе рибосомальной РНК и всем, что с этим связано(регуляция, сборка и тд), а остальные – другие функции. Оказалось, что ядрышко участвует в реакции клетки на стресс, в репарации ДНК (косвенно) и во многих других важных общеклеточных процессах. Внутри ядрышка тоже есть определенные участки, некоторые из них предназначены для синтеза рРНК, некоторые для сборки рибосом и так далее.

Кроме ядрышка мы видим другие образования (о некоторых мало, что известно): ядерные спеклы (спекл – пятнышко), сначала их считали сайтами сплайсинга, но это ошибочно. Это структуры, состоящие из многих РНК-связывающих белков, которые являются депо факторов сплайсинга и процессинга белков. Около спеклов (зеленые) располагаются розовые параспеклы. Еще есть тельца Поликомб Боди (сегодня ничего не будет говорить). Наконец, имеется тельце Кахаля, где осуществляются модификации РНК для сплайсинга, в том числе модификация из уридина в псевдоуриин (раньше была описана). Вы видите, что какие-то участки ДНК связаны с ламиной (белки, выстилающие ядерную мембрану изнутри) – эти гены, как правило, неактивны (не без исключений).
Ядрышко. Здесь функционирует РНК-полимераза 1. Сами рибосомные РНК – тоже некодирующие. Но в регуляции их образования принимает участие другие регуляторные РНК. Гены, кодирующие рРНК представлены повторами. Одни участки транскрибируются, а между ними спейсеры и думали, что они не транскрибируются. Все хорошо знают картинку-елочку, где видно, что какие-то участки транскрибируются, а какие-то молчат. Но дальше выяснилось, что участки между генами, кодирующими рРНК, тоже транскрибируются, причем эта РНК тоже некодирующая, она не входит в состав рибосом, но является регуляторной для того, чтобы запретить синтез части генов рибосомальной РНК. В клетке очень много генов рРНК и часть этих копий клетке не нужна в данный момент, вот и надо, чтобы они молчали. Существует регуляция (сайленсинг) этих копий, чтобы экономить энергетические ресурсы. Как осуществляется регуляция этих копий – образуется достаточно длинная нкРНК, которая потом довольно быстро деградирует на фрагменты 200 нуклеотидов. Но своим образованием она привлекает комплексы модификации хроматина (на картинке условно 3 комплекса разными цветами), которые писатели (в данном случае). Тут они записали негативную метку для гистона Н4, в итоге ген молчит. Кроме того, для этой модификации привлекается определенный комплекс ремоделинга. Какой-то фрагмент образовавшейся РНК с межгенного спейсера может давать с промотерным участком триплексную структуру (здесь изображена очень схематично, ведь структура ДНК тоже меняется), которая привлекает ДНК-метилтрансферазу (ДНК метилируется по цитозину и это, как правило, является репрессорной меткой для промотерных районов и самих генов).

Елочка – торчат транскрипты и на них садятся белки. Консервативны.
Межгенные спейсеры – разны последовательности, удивительно полиморфны и не консервативны.
На картинке – ядрышко в ядре. Желтый – тетрамерный р53 (следит за невозникновением опухолей и все такое). Есть регуляторы этого белка (сине-фиолетовым) – убиквитин-лигазы (HDM2), которые способствуют тому, что количество р53 регулируется. В нуклеоплазме есть комплексы между р53 и его регуляторами. Межгенные спейсеры молчат. Дальше наступает стресс (тепловой шок, изменение рН, осмотический шок и тд), тогда межгенные спейсеры начинают транскрибироваться (либо длинными РНК, либо независимо друг от друга), и тогда участки нкРНК (полиморфная) приобретает какие-то структуры, которые привлекают к себе белки, в том числе убиквитин-лигаза прикрепляется к участку транскрибируемого спейсера, а красный белок прикрепляется к другому району. И количество свободных молекул р53 в нуклеоплазме сильно увеличивается (за счет ухода синей убиквитин-лигазы). р53 – транс-активирующий белок, ему доступно множество генов, которые он будет запускать, чтобы они спасали от этого стресса. Разные нкРНК межгенного спейсера взаимодействуют с разными белками.

Спеклы - в них локализуется нкРНК, которая получила название МАLAT (metastasis associated long adenocarcinoma transcript). В раковых перерождениях образуется РНК в районе генной пустыни, которая характеризует активно-размножающиеся и агрессивно- метастазирующие клетки. Приготовили пробы. Выяснили, что эта РНК (LINC, 7000 п.н.) – локализована в спеклах.
На картинке: А - NEAT1 (тоже из генных пустынь) paraspeckles, В - MALAT, 7 кб, SPECKLES, С – cовмещение.

Ну раз MALAT в спеклах, то наверное участвует в сплайсинге. Коротко вспомним о сплайсинге. SR-белки – РНК-связывающие, богаты серином и аргинином, они связываются с экзоном, а именно с ESE (энхансер экзона). Фосфорилирование SR белков осуществляется. нкРНК МАЛАТ связывается с определенными SR белками и поределяет их фосфорилирование.

Оказалось, что МАЛАТ в клетках Hela может модулировать альтернативный сплайсинг (идет по-разному в зависимости от количества активной МАЛАТ РНК в клетке).
Как выключатся МАЛАТ РНК – делалась искусственная антисмысловая РНК в виде олигонуклеотидов, которая ее инактивирует. Такой комплекс деградирует в клетке.
В норме – нормальный альтернативный сплайсинг, SR белки фофорилированы (шарики) (Еа на картинке). А МАЛАТ взаимодействует непосредственно с этими белками в спеклах и когда они идут к сайтам сплайсинга, то оказываются недофосфорилированы, если МАЛАТ нет, (Еб). И тот экзон, который должен быть удален – не удаляется и разные альтернативные формы. В отсутствии МАЛАТ - нарушение альтернативного сплайсинга.

Это было показано на клетках человека, а на мышах не получилось существенного эффекта с помощью антисмысловой искусственной РНК. Тогда на мышах решили применить другой подход, который снижает количество РНК МАЛАТ более чем в тысячу раз (антисмысловая снижала в 200 раз примерно) – тут уже видны эффекты.
Возникла технология дизайна цинковых пальцев (ощупывают ДНК и узнают специфические последовательности ДНК). Можно сделать разные цинковые пальцы для конкретных последовательностей. Если смешать цинковые пальцы с эндонуклеазой, то получаться димерные химерные белки. Эндонуклеаза будет делать двунитевые разрывы. И разрывы будут в совершенно определенном месте ДНК. Такой разрыв должен определенным образом залечиваться. И если подсунуть в такую систему определенную ДНК- кассету, то она вставляется в то место, где разрезали эти цинковые пальцы+эндонуклеаза.
В раковых клетках мышей в ген, кодирующий МАЛАТ, вставили чужеродную кассету, которая транскрибируется вместе с РНК МАЛАТ, но эта кассета имеет в составе нуклеотидную последовательность с полиА сигналом (привлекает эндонуклеазы, которые осуществляют терминацию транскрипции). Или в составе кассеты последовательность рибозима, который способен самовырезаться. Если он вырезался, то убил эту РНК.

Получилось, что при нокауте гена, кодирующего МАЛАТ (таким интересным способом) - можно эти мышиные раковые клетки инъецировать мыши и тогда нет опухоли. В опухолевых клетках узлы, а если инъецировать клетки с нокаутом, то очень мало опухолей. То есть получилось, что МАЛАТ тесно связан с процессами метастазирования. Много МАЛАТа – плохой прогноз для опухоли. Таким способом можно пользоваться в терапии, чтобы останавливать транскрипцию этого МАЛАТа.

 2014-02-02
2014-02-02 1419
1419