| Значение l | ||||
| Форма электронного облака |  | 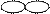 |  |  |
| Подуровень | s | p | d | f |
| Число АО | ||||
| Графическая схема подуровня |  |  |  |  |
| Значения ml | –1, 0,+1 | –2,–1, 0,+1,+2 | –3,–2,–1, 0,+1,+2,+3 |
Электроны в атоме заполняют АО в соответствии со следующими принципами и правилами:
1. Принцип минимальной энергии: электроны в атоме стремятся занять в первую очередь те АО, которым соответствует наименьшее значение энергии электрона.

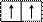 2. Правило Хунда (Гунда): в пределах одного подуровня электроны располагаются так, чтобы их суммарный спин был максимальным. Это означает, что в первую очередь электроны заполняют все свободные АО подуровня по одному, имея при этом одинаково направленные спины (их называют параллельными), а затем происходит заполнение этих АО вторыми (парными) электронами (их называют антипараллельными).
2. Правило Хунда (Гунда): в пределах одного подуровня электроны располагаются так, чтобы их суммарный спин был максимальным. Это означает, что в первую очередь электроны заполняют все свободные АО подуровня по одному, имея при этом одинаково направленные спины (их называют параллельными), а затем происходит заполнение этих АО вторыми (парными) электронами (их называют антипараллельными).
 3. Принцип Паули: на одной АО может находиться не более двух электронов, отличающихся друг от друга значением ms (). Таким образом, максимальное число электронов на любом s -подуровне равно 2
3. Принцип Паули: на одной АО может находиться не более двух электронов, отличающихся друг от друга значением ms (). Таким образом, максимальное число электронов на любом s -подуровне равно 2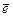 (в электронной формуле соответствует записи ns 2), p -подуровне – 6
(в электронной формуле соответствует записи ns 2), p -подуровне – 6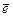 (np 6), d -подуровне – 10
(np 6), d -подуровне – 10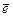 [(n – 1) d 10], f -подуровне – 14
[(n – 1) d 10], f -подуровне – 14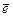 [(n – 2) f 14].
[(n – 2) f 14].
2. Правило Клечковского: с ростом атомного номера элемента электроны размещаются на АО последовательно по мере возрастания суммы (n + l); при одинаковых значениях этой суммы раньше заполняется АО с меньшим значением числа n.
Например: 4 s -орбиталь заполняется электронами раньше, чем 3 d, потому что сумма (n + l) для 4 s равна (4 + 0) = 4, а для 3 d равна (3 + 2) = 5.
По правилу Клечковского заполнение энергетических уровней в основном соответствует следующему ряду: 1 s, 2 s, 2 p, 3 s, 3 p, 4 s, 3 d, 4 p, 5 s, 4 d, 5 p, 6 s, 4 f, 5 d, 6 p, 7 s, 5 f, 6 d, 7 p и т.д.
У некоторых элементов ПС заполнение АО электронами происходит с нарушением правила Клечковского. Например: в соответствии с данным правилом электронная формула 29Cu должна заканчиваться …4 s 23 d 9, а на самом деле она имеет вид …4 s 13 d 10. Таким образом, один электрон с внешнего 4 s подуровня перешел («провалился») на внутренний 3 d и завершил его формирование (число электронов достигло максимума – 10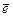 ). Этот и другие подобные факты связаны с тем, что полностью и наполовину заполненным подуровням соответствуют более выгодные с точки зрения энергии электронные конфигурации (они легче возникают и их сложнее разрушить).
). Этот и другие подобные факты связаны с тем, что полностью и наполовину заполненным подуровням соответствуют более выгодные с точки зрения энергии электронные конфигурации (они легче возникают и их сложнее разрушить).
При отрыве электронов от атома он превращается в положительно заряженный ион – катион, заряд которого равен числу отнятых электронов. Присоединение же электронов к атому приводит к образованию отрицательного иона – аниона, заряд которого равен количеству принятых электронов. При образовании катионов электроны в первую очередь покидают внешний энергетический уровень, а при образовании анионов размещаются на уровнях с соблюдением правила Клечковского.
Электроны внешнего энергетического уровня и отдельных подуровней второго (а для лантаноидов и актиноидов – третьего) от конца электронного слоя, на которых количество электронов не достигло максимального значения, называются валентными.
Элементы, в атомах которых валентными являются только s -орбитали, относятся к семейству s -элементов; элементы, в которых кроме s -орбиталей валентными являются также и p -орбитали, относятся к семейству p -элементов и т.д.
Способность атомов терять или присоединять электроны определяет химическую активность соответствующего элемента. Эту способность характеризуют при помощи следующих основных свойств атомов:
1. Энергия ионизации I – энергия, необходимая для удаления 1 моль электронов от 1 моль атомов какого либо элемента. Ее измеряют в кДж/моль или в электрон-вольтах (1 эВ = 1,6×10-19 Дж). Отрыву первого электрона от нейтрального атома соответствует первая энергия ионизации I 1, отрыву второго, третьего и т. д. электронов соответствует вторая I 2, третья I 3 и т. д. энергии ионизации. При переходе от I 1 к I 2, I 3 и т.д. энергия ионизации увеличивается. Наименьшее напряжение электрического поля, при котором происходит отрыв электрона, называется потенциалом ионизации. Его численное значение равно энергии ионизации в эВ.
Энергия ионизации характеризует восстановительную способность элемента. Чем меньше значение I, тем более сильным восстановителем является атом. В периодах с увеличением порядкового номера элемента (слева направо) I 1 имеет общую тенденцию к росту. Однако, у электронных конфигураций, имеющих полностью или наполовину сформированные валентные подуровни, проявляются локальные максимумы значений I 1.
Например, во втором периоде при переходе от N7: 1 s 22 s 22 p 3 к О8:1 s 22 s 22 p 4 порядковый номер увеличивается, а первая энергия ионизации уменьшается от 14,53 эВ у азота до 13,61 эВ у кислорода.
В общем случае локальные максимумы значений I 1 следует ожидать у атомов, чья электронная формула заканчивается … ns 2, … np 3, … np 6, …(n – 1) d 5, …(n – 1) d 10 и т.д.
Общие тенденции изменения значения I 1 и некоторых других свойств атомов в периодах и группах приведены в табл.3.
Таблица 3
 2014-02-02
2014-02-02 948
948








