Если
График зависимости скорости ферментативной реакции
В случае, если скорость ферментативной реакции ровна половине максимальной (на графике), уравнени можно преобразовать:
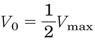
уравнение приобретает вид:
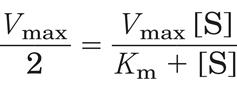
Разделив обе половины уравнения на Vmax получаем:
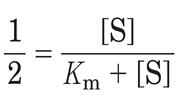
Решая его относительно K m получаем:
K m + [S] = 2[S] или
K m = [S]
Константа Михаэлиса - это концентрации субстрата при которой скорость ферментативной реакции ровна половине максимальной.
Определение константы Михаэлиса позволяет говорить о сродстве (связывании) фермента и субстрата: чем ниже K m, тем выше сродство и наоборот.
В практической энзимологии применяется уравнение Михаэлиса-Ментен в преобразовании Лайнвивер-Бэрка (Lineweaver-Burk). Для точных расчётов кривая уравнения Михаэлиса-Ментен не годится. Но если обе половины уровнения преобразовать следующим образом:
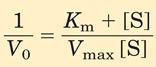
и упростить:
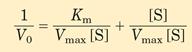
то в конечном результате получим уравнение Лайнвивер-Бэрка:
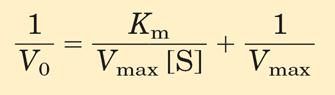
График зависимости обратных величин скорости ферментативной реакции (1/V0) и концентрации субстрата (1/[S]) выглядит следующим образом:
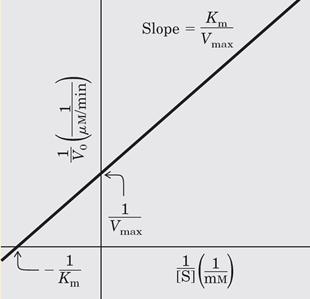
Использование уравнение Лайнвивер-Бэрка позволяет получать более точные результаты, и даже выяснять характер ферментативной реакции и типы ингибирования.
 2014-02-02
2014-02-02 1093
1093
