Температурные подходы, которые используются для объяснения температурной зависимости обычных химических реакций, в принципе применимы и к ферментативным реакциям. На практике при изучении влияния температуры на ферментативные реакции возникает ряд сложностей. Прежде всего, все ферменты при температурах, заметно превышающих физиологические, денатурируют. При этом не происходит разрыва ковалентных связей, рвутся лишь водородные и другие слабые связи, участвующие в стабилизации конформации фермента, соответствующей активной форме. Энергия водородной связи составляет 20 кДж / моль; энергия ковалентной связи равна приблизительно 400 кДж / моль. Процесс денатурации белка обычно сопровождается разрывом большого числа слабых связей, поэтому стандартное изменение энтальпии (∆ НО) для реакции денатурации достаточно велико (200-500 кДж / моль). Разрыв большого числа водородных связей существенно повышает число конформационных состояний молекулы фермента, поэтому процесс денатурации характеризуется очень большим стандартным изменением энтропии (∆ SО).
Влияние денатурации на экспериментально наблюдаемые константы скорости ферментативной реакции можно показать, рассмотрев следующую простую реакцию (1.55):
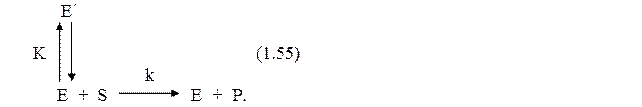
Здесь активный фермент Е находится в равновесии с неактивной формой Е', а каталитический процесс представлен простой реакцией второго порядка, как это обычно имеет место при очень низких концентрациях субстрата. Зависимость константы равновесия (К) для процесса денатурации от температуры описывается уравнением Вант-Гоффа:
− R ∙ T ∙ ln K = ∆ GО = ∆ НО − T ∙ ∆ SО, (1.56)
где: R – универсальная газовая постоянная; Т – абсолютная температура; ∆ GО, ∆ НО,∆ SО – стандартные изменения свободной энергии Гиббса, энтальпия и энтропия соответственно для процесса денатурации. Отсюда константу равновесия можно выразить следующим образом:
К = exp (∆ SО / R − ∆ НО / R ∙ T). (1.57)
Зависимость константы скорости k от температуры подчиняется уравнению Аррениуса, представленному в интегральной форме:
k = A ∙ exp (−Ea / R ∙ T), (1.58)
где: А – константа (предэкспоненциальный множитель); Ea – энергия активации. Скорость реакции определяется выражением υ = k ∙ [E] ∙ [S], в котором концентрацию активного фермента [E] необходимо выражать через полную (начальную) концентрацию фермента [E]О. В результате получаем:
υ = k ∙ [E] ∙ [S] / (1 + К). (1.59)
Наблюдаемую константу скорости kНАБЛ можно записать как k / (1 + К); она изменяется при изменении температуры по следующему закону:
A ∙ exp (−Ea / R ∙ T)
kНАБЛ = —————————————. (1.60)
1 + exp (∆ SО / R − ∆ НО / R ∙ T)
При низких температурах, когда величина ∆ SО / R мала по сравнению с ∆ НО / R ∙ T, вклад экспоненциального члена в знаменателе является несущественным, и поэтому зависимость наблюдаемой константы скорости (kНАБЛ) от температуры описывается простым уравнением Аррениуса. Однако при температурах выше, чем ∆ НО / ∆ SО знаменатель обычно очень быстро растет с увеличением температуры, в результате чего скорость падает до нуля.
При исследовании влияния температуры на ферменты учитывают несколько особенностей этих реакций:
- из-за трудностей, связанных с денатурацией, исследования температурной зависимости скорости ферментативных реакций обычно дают надежные результаты только в узком интервале температур (0 – 50 ºС);
- другое замечание касается того, что изучать температурные зависимости параметров υm, υm / Кm, Кm нельзя, если неясен их физический смысл. Если параметр Кm является функцией нескольких констант скорости, то температурная зависимость этого фактора будет определяться сразу многими факторами и поэтому не будет представлять интереса. Однако, если с достаточной достоверностью известно, что Кm представляет собой истинную константу диссоциации, то из температурной зависимости параметра Кm можно получить данные о термодинамике процесса связывания субстрата ферментом. Аналогичным образом температурная зависимость параметра υm представляет интерес только в том случае, если известно, какую стадию ферментативной реакции этот параметр характеризует;
- другое обстоятельство состоит в том, что влияния рН и температуры на ферменты не являются независимыми, поскольку константы ионизации зависят от температуры (например, константа ионизации воды (КW), имеет достаточно высокую зависимость от температуры).
 2014-02-12
2014-02-12 747
747








