Тема: Основные понятия и законы термодинамики. Первое начало термодинамики. Степени свободы системы. Распределение энергии по степеням свободы. Внутренняя энергия идеального газа. Молярная и удельная теплоемкости. Изопроцессы: изохорный, изобарный, изотермический и адиабатический.
Термодинамика – это наука о тепловых явлениях в телах (системах) с огромным числом молекул атомов. Все тепловые процессы связаны с передачей и превращением энергии.
Термодинамика не касается микропроцессов, лежащих в основе этих превращений. Этим термодинамический метод исследования явлений отличается от рассмотренного выше молекулярно-кинетического, или статистического, метода.
Термодинамическая система – тело или совокупность тел, условно выделенных из окружающей среды для более удобного рассмотрения происходящих в них процессов, которые могут обмениваться между собой, а также с внешней средой энергией и веществом.
Изолированная система – системы, которая не обмениваются энергией с окружающей средой. При неизменных внешних условиях в изолированной системе устанавливается равновесное состояние, при котором макропараметры системы (температура, давление, объем) сохраняют постоянное значение сколь угодно долго. Изолированная система, находящаяся в неравновесном состоянии, самопроизвольно переходит в равновесное.
Переход системы из одного состояния в другое, происходит через ряд промежуточных состоянии, и называется термодинамическим процессом. Процесс, который может самопроизвольно протекать как в прямом, так и в обратном направлениях, называется обратимым. Обратимый процесс состоит из последовательного ряда равновесных состоянии. Такой процесс является идеализированным. К нему приближаются процессы, протекающие настолько медленно, что каждое из промежуточных состояний успевает достаточно приблизиться к равновесному. Эти процессы называются квазистатическими и к ним можно отнести, например, все достаточно медленно протекающие процессы сжатия, расширения, нагревания и охлаждения газа. Необратимым называется процесс, в котором хотя бы одно промежуточное состояние не является равновесным и процесс нельзя провести в обратном направлении через те же промежуточные состояния. Необратимыми являются, например, быстро протекающие процессы сжатия, расширения, нагревания и охлаждения газа. По природе необратимыми процессами являются расширение газа в высокий вакуум, взаимная диффузия газов (или любых веществ), передача теплоты путем теплопроводности и другие.
Первое начало термодинамики устанавливает количественные соотношения при превращении теплоты в механическую работу (или другие виды энергии). Второе начало указывает направленность соответствующих процессов.
Первый закон термодинамики записывается в дифференциальной форме:
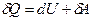
и читается: количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершаемую системой работу против внешних сил.
Внутренняя энергия тела (системы) – энергия данного тела (системы), зависящая только от его внутреннего состояния. С молекулярно-кинетической точки зрения, внутренняя энергия определяется суммой кинетической энергии отдельных молекул и энергией взаимодействия между ними. Изменение внутренней энергии dU не зависит от процесса и определяется параметрами начального и конечного состояния; напротив 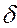 Q и
Q и 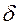 A зависят от процесса перехода из начального в конечное состояния.
A зависят от процесса перехода из начального в конечное состояния.
Полная работа А, совершаемая газом (системой) определяется путем интегрирования:
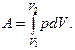
Результат интегрирования будет зависеть от характера зависимости между давлением и объемом газа. Различают четыре основных процесса изменения состояния идеального газа: изохорический, изобарический, изотермический и адиабатический.
Теплоемкость
Удельная терплоемкость вещества – величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К:
С = 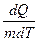 .
.
Молярная теплоемкость – величина, равная количеству теплоты, необходимому для нагревания 1 моля вещества на 1 К:
См = 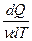 , где ν =
, где ν = 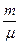 – число молей.
– число молей.
Удельная теплоемкость С связана с молярной соотношением См = Сm.
Различают теплоемкость при постоянном объеме и при постоянном давлении. Запишем уравнение первого начала термодинамики для 1 моля газа:
СmdT = dUm + P dVm.
Если газ нагревается при постоянном объеме, то работа внешних сил равна нулю и сообщаемая газу извне теплота идет на увеличение его внутренней энергии:
Cv = 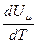 ,
,
т.е. молярная теплоемкость газа при постоянном объеме равна изменению внутренней энергии 1 моля газа при повышении его температуры на 1 К.
Однако dUm = 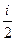 R dT, тогда Сv =
R dT, тогда Сv = 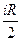 .
.
Если газ нагревается при постоянном давлении, то можно записать:
Ср = 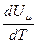 +
+ 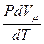 .
.
Учитывая, что 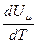 не зависит от вида процесса (от Р и V) и всегда равна Сv, то продифференцировав уравнение Менделеева – Клапейрона PVm = RT по Т (Р = const), получим:
не зависит от вида процесса (от Р и V) и всегда равна Сv, то продифференцировав уравнение Менделеева – Клапейрона PVm = RT по Т (Р = const), получим:
Ср = Сv + R.
Это выражение называется уравнением Майера. Оно показывает, что Ср всегда больше Сv на величину молярной газовой постоянной. Учитывая это выражение можно записать:
Ср = 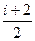 R.
R.
При рассмотрении термодинамических процессов важно знать отношение СP к СV:
g = 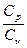 =
= 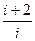 ,
,
т.е. молярные теплоемкости определяются лишь числом степеней свободы и не зависят от температуры. Однако это утверждение справедливо в довольно широком интервале температур лишь для одноатомных газов. Расхождение теории и эксперимента объясняется тем, что надо учитывать квантовые энергии вращения и колебания молекул, что не учитывается в молекулярно-кинетической теории.
 2014-02-02
2014-02-02 1548
1548
