Основным уравнением кинетической теории газов называют уравнение, устанавливающее связь между давлением газа, его объемом и энергией. Для идеального газа мы допускаем отсутствие взаимодействия молекул, а следовательно, энергия газа является только кинетической энергией движущихся молекул.
 ,
,
где n – число молекул в единице объема; m – масса молекулы;
V – средняя скорость молекулы. Учитывая, что кинетическая энергия
поступательного движения молекулы 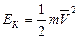 , можем записать предыдущее выражение в виде:
, можем записать предыдущее выражение в виде:
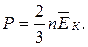
Уравнение (3.2) называется основным уравнением молекулярно-кинетической теории идеального газа. Основное уравнение позволяет сделать ряд выводов:
1. Произведение давления газа на его объем (для данной массы газа и при постоянной температуре) есть величина постоянная, равная кинетической энергии непрерывного хаотического поступательного движения молекул, т.е.
PV = 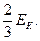
2. На основании формул (3.1) и (3.3) получаем, что кинетическая энергия идеального газа Е К прямо пропорциональна абсолютной температуре Т:
E К= 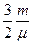 RT.
RT.
Кинетическая энергия одной молекулы будет: 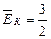 кТ,
кТ,
где К = 1,38 10-23 Дж/град. Эта зависимость позволяет вычислить скорости газовых молекул при заданной температуре: среднеквадратичную, среднеарифметическую и вероятную:
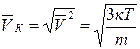 ,
, 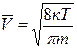 ,
, 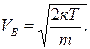
3. Кинетическую энергию движения частиц, также как и температуру, можно рассматривать как меру теплового движения. Учитывая выражение (3.5), получим зависимость: 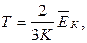
т.е. температура есть количественная мера энергии теплового движения молекул, из которыхсостоит тело. Определенная из этого условия шкала температур называется термодинамической (шкалой Кельвина). Нулем температуры в этой шкале является температура, при которой прекращается поступательное движение молекул. Прекращение поступательного движения молекул означает и отсутствие давления газа, так как
P = nkT, T =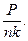
 2014-02-02
2014-02-02 2694
2694
