Основные выводы.
1. Температура определяет степень нагретости тела. Для измерения температуры используются приборы, называемые термометрами, основанные на изменении физических свойств вещества с изменением температуры.
Шкалы для измерения температуры:
Шкала Цельсия — фиксированные точки: точка кипения воды соответствует 100°С, точка замерзания воды соответствует 0°С, шкала делится на 100 делений (градусов). Шкала Фаренгейта — фиксированные точки — те же, но точка кипения воды соответствует 212°F, а точка замерзания соответствует 32°F. Шкала делится на 180 делений (градусов). Абсолютная шкала или шкала Кельвина — за абсолютный нуль Т = 0 К принята температура –273,15°С. Интервал на этой шкале такой же как и на шкале Цельсия. Переход от градусов Цельсия к Кельвинам: Т (К) = t (C) + 273,15.
2. Газовые законы:
Закон Бойля-Мариотта — при постоянной температуре объем газа обратно пропорционален приложенному к нему давлению или V = С 1 /Р.
Закон Гей-Люссака — при постоянном давлении объем газа прямо пропорционален абсолютной температуре или V = С 2 Т.
Закон Шарля — при постоянном объеме давление газа прямо пропорционально абсолютной температуре или Р = С 3 Т.
3. Закон кратных отношений: в химической реакции между двумя газами объемы реагирующих газов относятся как целые числа.
4. Закон Авогадро: равные объемы газа при одинаковых давлении и температуре содержат одинаковое количество молекул. Единицей количества вещества является моль: 1 моль — это количество вещества, которое содержит число молекул, равное числу атомов в 0,012 кг изотопа углерода С12. Моли всех газов при одинаковых температурах и давлениях занимают одинаковые объемы. (При t = 0°С и Р = 1 атм объем моля любого газа равен 22,4 л). Число молекул, содержащееся в 1 моле вещества называется числом Авогадро. Оно равно: NA = 6,02×1023 моль–1.
5. Соотношение между давлением, объемом, температурой (или средней кинетической энергией молекул), массой газа называется уравнением состояния газа.
Закон Менделеева-Клапейрона для идеального газа (уравнение состояния идеального газа):
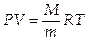 ,
,
где М — масса газа, m — масса одного моля газа и R — универсальная газовая постоянная R = 8,31 Дж/(моль.К).
Введем величину k = R/N Аи n — число молей газа. Тогда PV = nN А kT = NkT Величина k называется постоянной Больцмана k =1, 38×10–23 Дж/К.
6. Уравнение состояния газа, полученное на основании молекулярно-кинетических представлений и законов Ньютона: 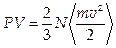 , откуда
, откуда 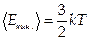 , где N — число молекул,
, где N — число молекул,  — средняя кинетическая энергия молекул.
— средняя кинетическая энергия молекул.
7. Закон Дальтона: давление смеси газов, заключенных в одном объеме, равно сумме парциальных давлений Р = р 1 + р 2 +... + рn. Парциальное давление pi равно давлению i -того газа, если бы он содержался в объеме один.
 2014-02-02
2014-02-02 507
507








