План
1. Сущность метода. Равновесие в растворах, содержащих осадки.
2. Факторы, влияющие на растворимость осадков.
3. Классификация методов осадительного титрования.
4. Методы осалительного титрования (Мора, Фаянса, Фольгарда).
5. Кривые титрования.
6. Применение метода.
1. Метод основан на применении реакций с образованием труднорастворимых соединений. Чтобы реакцию можно было применить в титриметрическом анализе она должна отвечать требованиям:
1. Образующийся осадок должен иметь минимальную константу растворимости ПР (Кs);
2. Минимальное соосаждение примесей;
3. Возможность фиксирования точки стехиометричности;
Система, содержащая осадок называется гетерогенной, т.е. в контакте находятся минимум 2 фазы – жидкая (раствор) и твердая (осадок).
В системе с AgCL происходит 2 конкурирующих процесса:
1) растворение осадка
AgCl↓ → Ag+ + Cl-
v1 – скорость реакции растворения
2) образование твердой фазы
Ag+ + Cl-→ AgCl↓
v2 – скорость реакции осаждения.
При достижении равновесия v1 = v2
v1 = const, т.к. число ионов Ag+ и Cl-, переходящих в раствор с единицы поверхности твердой фазы в единицу времени, пропорционально число ионов Ag+ и CL- на единице поверхности.
V1 = k1
Скорость реакции осаждения согласно закону действия масс равна:
V2 = k2 aAg+aCl-. если раствор насыщен, то k1 = k2 aAg+aCl-.
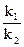 =Ks = k2 aAg+aCl-. = Ks(ПР)
=Ks = k2 aAg+aCl-. = Ks(ПР)
при С→0, aAg+ =[Ag+]; aCL-. = [Cl-].
Произведение растворимости (константы растворимости) – произведение активностей ионов труднорастворимого электролита в насыщенном растворе при постоянной температуре.
В насыщенном растворе произведение концентрации = ПР(Ks)
в ненасыщенном растворе произведение концентрации < Ks
в пересыщенном растворе произведение концентрации > Ks – термодинамически неустоичивая система.
Осадок выпадет, если произведение концентрации ≥ Ks.
 2014-02-02
2014-02-02 517
517








