Лекция 9
Недостатки метода.
Достоинства метода.
Способы определения концентрации
Способ атомизации.
В ААС аналитический сигнал получают от невозбуждённых атомов, поэтому для атомизации подходят лишь такие источники, энергии которых хватает для распада вещества на атомы, но не для возбуждения атомов. Такими атомизаторами являются пламя и электротермический атомизатор-графитовая кювета, которую нагревают с помощью электрического тока. Анализируемый раствор с помощью распылителя переводится в аэрозоль и подаётся в пламя горелки. Под действием высокой температуры растворитель испаряется, а находящиеся в растворе соли распадаются на атомы, способные поглощать излучение.
Источником излучения является лампа с полым катодом. Лампа с полым катодом представляет собой стеклянный или кварцевый баллон, заполненный инертным газом, внутри которого находятся два электрода-катода и анод. Катод изготавливается из того же металла, который нужно определять. При подаче напряжения на электроды возникает тлеющий разряд с образованием положительных ионов газа- наполнителя, например аргона. Положительные ионы бомбардируют катод, выбивая атомы металла в газовую фазу. Там эти атомы возбуждаются и испускают излучение.
Излучение направляют на пламя (или графитовую кювету), где находятся атомы определяемого элемента. Таким образом, для определения каждого элемента нужна своя лампа.
Приёмником света, прошедшего через пробу, является фотоэлемент или фотоумножитель.
Поглощение излучения атомами подчиняется тем же законам, что и поглощение молекулами. Сигнал прямо пропорционален концентрации определяемого компонента. Для определения концентрации используют метод градуировочного графика и метод добавок.
- Высокая чувствительность, до 10-3 мкг/мл.
- Высокая избирательность.
- Экспрессность, т.е. быстрота анализа.
Методом ААС можно определять около 70 элементов в периодической системе Менделеева. Этот метод успешно применяется для определения цинка, железа, марганца и некоторых других элементов в почвах, удобрениях, растениях, водах и т.д. Используется также в клинических и биологических анализах.
- Для определения каждого элемента нужна своя лампа.
- Определение только одного элемента в пробе.
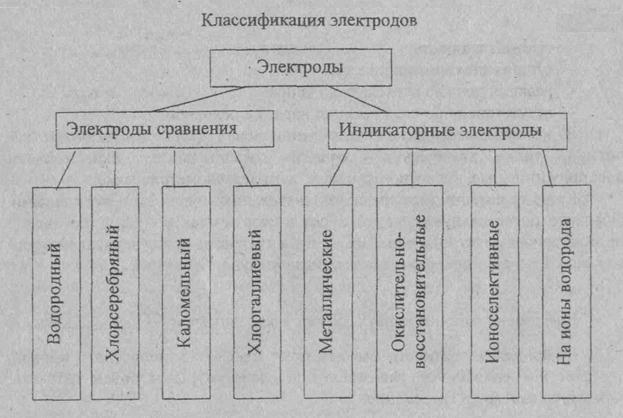
Хлорсеребряный электрод
Ag | AgCl | KCl
Каломельный электрод
Hg | Hg2Cl2 | KCl
Электрохимическая реакция – реакция на электроде
AgCl + e → Ag0 + Cl-
Потенциал хлорсеребряного электрода равен
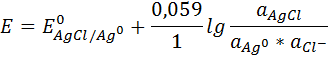
aAgCl = 1
aAg = 1
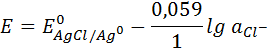
Реакция в растворе Ag+ + Cl- → AgCl
Электрохимическая реакция на электроде Ag+ + e → Ag0↓
E = E0 + 0,059 lg C (Ag+)
Серебряный электрод можно применять для определения ионов серебра.
Для определения ионов ртути (I) нужен ртутный электрод.
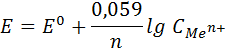
Индикаторные электроды из благородных металлов (платина, золото, палладия) являются индикаторными для окислительно-восстановительных систем.
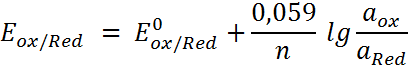
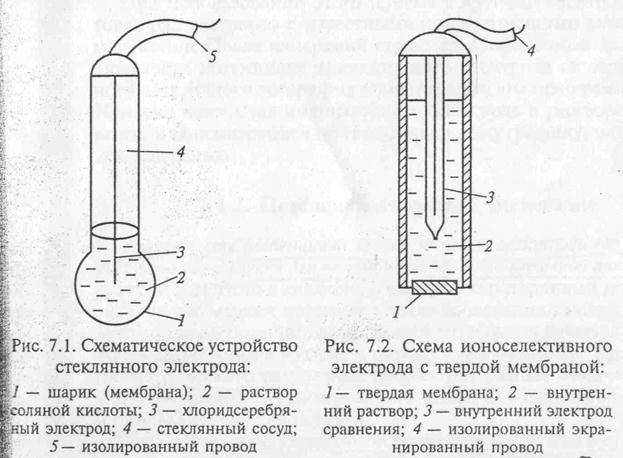
Потенциал ионоселективного электрода
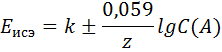
 2014-02-02
2014-02-02 2230
2230