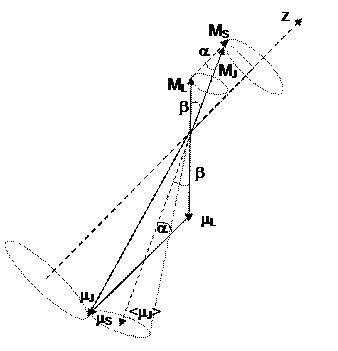 Движение электронов в других атомах (помимо H) определяется теми же квантовыми числами (можно и n, l, j, mj). Но влияние на движение электрона других электронов приводит к тому. Что его энергия зависит и от числа l (кроме n).
Движение электронов в других атомах (помимо H) определяется теми же квантовыми числами (можно и n, l, j, mj). Но влияние на движение электрона других электронов приводит к тому. Что его энергия зависит и от числа l (кроме n).
Механические и магнитные моменты атомов складываются из орбитальных и спиновых моментов отдельных электронов.
Возможны два случая:
1. Если орбитальные моменты 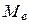 связаны между собой сильнее, чем с
связаны между собой сильнее, чем с 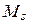 и наоборот (такая связь называется LS -связью), то все моменты
и наоборот (такая связь называется LS -связью), то все моменты 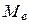 складываются в суммарный орбитальный момент атома
складываются в суммарный орбитальный момент атома 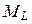 , а все
, а все 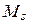 в суммарный спиновый момент
в суммарный спиновый момент 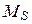 . А потом находится полный момент атома
. А потом находится полный момент атома  .
.
Результирующий орбитальный момент импульса для SL- связи
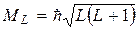
где L – орбитальное квантовое число атома.
Для двух электронов 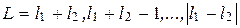
Проекция момента импульса атома на некоторое напр-е
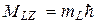
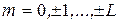
Также и для полного спинового момента
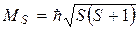
S – в зависимости от четного или нечетного числа электронов

Тогда полный орбитальный момент атома

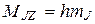
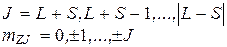
Векторная модель строится по следующим правилам. Пусть известен модель момента импульса и его одна проекция М и Мz (Мx и Мy – не определены). Следовательно, 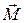 может иметь направление одной из образующих конуса (совершает прецессию).
может иметь направление одной из образующих конуса (совершает прецессию).
|
|
|
То, что проекция полного момента атома квантуется, было доказано опытами в 1922 году Штерном и Герлихом.
Состояние электронов в атомах позволяет объяснить принцип Паули (1925 г.): в одном и том же атоме (или другой квантовой системе) не может быть двух электронов (либо других частиц со спином 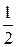 ), обладающих одинаковой совокупностью квантовых чисел. (В одном и том же состоянии не могут находится 2 электрона).
), обладающих одинаковой совокупностью квантовых чисел. (В одном и том же состоянии не могут находится 2 электрона).
Тогда кратность выражения уровня будет определяться 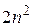
| Оболочка | |||
| На уровне с энергией | n = 1 | 2 эл. | K |
| n = 2 | 8 эл. | L | |
| n = 3 | 18 эл. | M | |
| n = 4 | 32 эл. | N | |
| n = 5 | 50 эл. | O | |
| P |
Принцип Паули дает объяснение периодической повторяемости свойств атомов.
Принцип запрета Паули
Состояние электронов в атомах позволяет объяснить принцип Паули (1925 г.): в одном и том же атоме (или другой квантовой системе) не может быть двух электронов (либо других частиц со спином  ), обладающих одинаковой совокупностью квантовых чисел. (В одном и том же состоянии не могут находится 2 электрона).
), обладающих одинаковой совокупностью квантовых чисел. (В одном и том же состоянии не могут находится 2 электрона).
В таблице все возможные квантовые состояния атома водорода и соответствующие им ориентации орбитального  и спинового
и спинового  моментов электрона. Стрелками обозначены направления векторов. Учет приводит к тому, что уровни энергий, описываемые формулой (
моментов электрона. Стрелками обозначены направления векторов. Учет приводит к тому, что уровни энергий, описываемые формулой (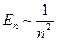 ), расщепляются на несколько уровней, соответствует нескольким значениям
), расщепляются на несколько уровней, соответствует нескольким значениям 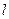 и
и 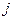 .
.
Распределение электронной плотности для состояний с заданным главным числом 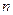 , но с разными значениями орбитального
, но с разными значениями орбитального 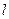 и магнитного
и магнитного 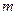 - квантовых чисел, существенно отличаются. Хотя, согласно формуле (
- квантовых чисел, существенно отличаются. Хотя, согласно формуле (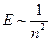 ), им соответствует одна и та же энергия (
), им соответствует одна и та же энергия (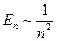 ).
).
|
|
|
 2014-02-02
2014-02-02 6060
6060








