В такой системе, содержащей в своем составе слабую кислоту, различают общую, активную и потенциальную кислотности:
1) общая кислотность соответствует максимально возможной концентрации ионов Н+ в данном растворе, если теоретически предположить, что все имеющиеся в нем молекулы кислоты полностью распадутся на ионы, а гидролиз имеющейся соли можно не учитывать. Общая кислотность численно равна молярной концентрации химического эквивалента кислоты в растворе и определяется опытным путем (например, с помощью титриметрического метода анализа);
2) активная кислотность равна концентрации (или активности) содержащихся «свободных» ионов Н+ (Н3О+), образовавшихся в результате диссоциации некоторого количества молекул кислоты;
3) потенциальная кислотность определяется совокупностью присутствующих в системе недиссоциированных молекул кислоты.
Потенциальная кислотность может быть вычислена вычитанием из общей кислотности активной.
Например, для ацетатного буфера все эти виды кислотности можно условно представить следующим образом:
| СН3СООН | 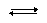 | Н+ | + | СН3СОО– |
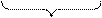 | 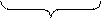 | |||
| потенциальная кислотность | активная кислотность | |||
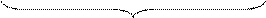 | ||||
| общая кислотность |
По аналогии с растворами слабых кислот в растворах слабых оснований (оснóвные буферные системы) можно также различать общую, активную и потенциальную щелочность или оснóвность.
 2014-02-02
2014-02-02 1797
1797








