Следует отметить, что в таких случаях гидролиз протекает, главным образом, по первой стадии и в очень малой степени. По последующим стадиям он идет гораздо хуже и им можно пренебречь. Это связано с тем, что продукты, образующиеся на поздних стадиях гидролиза (Н2S), являются более сильными электролитами, чем продукты, образующиеся на первой стадии (НS-), и лучше диссоциируют на ионы.
3. Соли, образованные сильной кислотой, но слабым основанием:
Cu(OH)2 + H2SO4 = CuSO4 + 2 H2O
слабое сильная
основание кислота
Zn(OH)2 + 2 HCl = ZnCl2 + 2 H2O
слабое сильная
основание кислота
В водных растворах таких солей с H2O будут взаимодействовать катионы слабого основания (т.е. ионы металлов или NH4+), образующиеся при диссоциации соли:
ZnCl2 → Zn 2+ + 2 Cl¯
Они будут присоединять к себе гидроксильные ионы, отщепившиеся от молекул H2O, в результате чего образуется слабый электролит (ZnОН+), а в растворе станут накапливаться ионы Н+, которые сообщат раствору такой соли кислую реакцию.
Zn 2+ + НОН 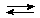 ZnОН+ + Н+
ZnОН+ + Н+
В результате этого рН растворов солей, образованных слабым основанием и сильной кислотой, будет < 7, а в самом растворе станут присутствовать основная соль и сильная кислота.
В молекулярном виде уравнение гидролиза в этом случае можно записать так:
ZnCl2 + НОН 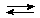 ZnОНCl + НCl
ZnОНCl + НCl
Чем более слабым электролитом является основание, образующее соль, тем сильнее протекает ее гидролиз.
Если соль образована многокислотным слабым основанием, то ее гидролиз может протекать в несколько стадий:
|
 Cu2+ + НОН
Cu2+ + НОН 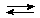 CuOH+ + Н+
CuOH+ + Н+
молекулярное Cu(NO3)2 + НОН  CuОНNO3 + НNO3
CuОНNO3 + НNO3
 2014-02-02
2014-02-02 954
954








