Альдегиды. Альдегидами называют органические веще-
О
ства, в молекулах которых содержится группа —С—Н,
называемая альдегидной. В состав этой группы входит
карбонильная группа > С=0. То, что альдегидная
группа имеет такое строение, доказывается на основании
свойств альдегидов. Альдегиды образуются при окислении первичных спиртов.
Уксусный альдегид (а ц е т а л ь д е г и д). Физические и химические свойства. Уксусный альдегид — чрезвычайно летучая, легковоспламеняющаяся жидкость с резким запахом, хорошо растворимая в воде, спирте и многих других органических растворителях.
Предельно допустимая концентрация паров уксусного альдегида в воздухе производственных помещений 5 мг/м3.
Ацетальдегид легко полимеризуется, образуя при этом паральдегид — жидкость с температурой кипения 124°С и температурой плавления 12°С. Этим свойством альдегида (свойством превращаться в паральдегид)
пользуются для его перевозки и хранения. На месте потребления паральдегид деполимеризуют нагреванием, получая уксусный альдегид.
При поджигании ацетальдегид горит светящимся пламенем.
Хранят уксусный альдегид в ледниках, а транспортируют в термопосуде.
Получение и применение. Уксусный альдегид получают из ацетилена, присоединяя к нему воду (реакция Кучерова). Для этого смесь ацетилена с парами воды пропускают над катализаторами (оксиды металлов, ванадиевокислый цинк) при 400 °С.
Уксусный альдегид имеет большое значение как сырье для производства многих химических продуктов: уксусной кислоты, этилового спирта, эфира и т. д. Кроме того, ацетальдегид применяют как полупродукт в производстве красителей, лекарственных и душистых веществ.
Ацетальдегид образует с фенолом и белковыми веществами синтетические смолы, перерабатываемые в различные пластические массы. В такие же реакции вступает и формальдегид.
Кетоны. При окислении вторичных спиртов образуются кетоны. Например, при окислении вторичного пропилового спирта получается диметилкетон (ацетон).
Ацетон. Физические и химические свойства. Ацетон—бесцветная, легко воспламеняющаяся жидкость с характерным эфирным запахом. Температура кипения его 56,1°С, температура плавления минус 94,3°С, плотность 0,79 г/см15. Ацетон хорошо растворяется в воде, спиртах, эфирах, минеральных и растительных маслах, скипидаре и других веществах, является хорошим растворителем ацетилцеллюлозы, смол и жиров. Пары ацетона ядовиты, в два раза тяжелее воздуха и образуют с ним взрывчатые смеси. Концентрационные пределы воспламенения: НПВ —2,2%, ВПВ — 13%. Температурные пределы воспламенения ацетона: НПВ минус 20 °С,
ВПВ плюс 6 оС. При наличии источника воспламенения ацетон легко воспламеняется и горит светящимся пламенем
С3Н6О + 4О2 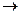 3СО2 + 3Н2О + Q
3СО2 + 3Н2О + Q
При горении ацетон прогревается в глубину, образуя гомотермический слой; скорость роста прогретого слоя 60 см/ч. Температура прогретого слоя достигает 56°С. Скорость выгорания ацетона со свободной поверхности
составляет 20 см/ч.
Определенную пожарную опасность представляют водные растворы ацетона. Водный раствор, содержащий только 10% (масс.) ацетона, является легковоспламеняющейся жидкостью с температурой вспышки 11 °С. Это свойство ацетона необходимо учитывать при использовании водных растворов его в технологическом процессе, а также при тушении горящего ацетона в резервуарах. Ацетон самовозгорается при контакте с сильными
окислителями: перекисью натрия, хромовым ангидридом, смесью серной кислоты с перманганатом калия или с бертолетовой солью (КСlO3) и др. Температура самовоспламенения ацетона 465°С, теплота сгорания 31012,8
кДж/кг. В присутствии щелочи он реагирует с иодом, хлором и бромом с образованием соответственно йодоформа, хлороформа и бромоформа.
При действии ультрафиолетовых лучей ацетон разлагается на этан и оксид углерода.
Получение и применение ацетона. В промышленности
ацетон получают разными способами.
Первый способ заключается в окислении вторичного пропилового (изопропилового) спирта. Реакцию проводят при 650°С и в присутствии катализатора (меди, серебра и др.).
Второй (основной) промышленный способ состоит в разложении гидропероксида изопропилбензола при нагревании с серной кислотой.
Гидропероксид изопропилбензола в свою очередь полу-
чают окислением изопропилбензола (кумола).
Третий способ — разложение паров уксусной кислоты
над катализатором (например, медью) при 400°С.
Ацетон — один из самых широко используемых растворителей. Его применяют в производстве лаков, бездымного пороха, хлороформа, йодоформа, искусственных красок, при изготовлении органического стекла, в производстве кинопленок, целлулоида и др. Он служит сырьем для получения синтетического каучука, индиго, сульфонола, находит применение в производстве кожи, для обезжиривания шерсти и меха. Чистый ацетон используют при экстрагировании пищевых продуктов, витаминов и лекарственных веществ, а также в качестве растворителя для хранения ацетилена. Его можно применять как добавку к моторному топливу для повышения октанового числа.
 2014-02-02
2014-02-02 3410
3410








