Наибольшее применение из многоатомных спиртов нашли этиленгликоль и глицерин.
Глицерин. Физические и химические свойства. Глицерин — представитель трехатомных спиртов. Это бесцветная, густая, сладкая на вкус жидкость, растворяется в воде. Растворы глицерина в воде имеют низкую температуру замерзания. При реакции с окислителями — перманганатом калия (КМпО4), перекисью натрия (Na202), хлорной известью Са(ОС1)2 — глицерин самовозгорается.
Атомный кислород является сильным окислителем и немедленно
реагирует с глицерином, вызывая самовозгорание его.
Хранение глицерина с сильными окислителями недопустимо, так как в случае контакта этих веществ может возникнуть пожар. Аналогично ведет себя с окислителями и этиленгликоль.
Тринитроглицерин — одно из сильнейших взрывчатых веществ, взрывается от удара, сотрясения, взрыва запала гремучей ртути, в результате саморазложения. Его применяют для приготовления нитроглицериновых порохов и динамитов.
Получение и применение. Глицерин получается в качестве побочного продукта в мыловаренной промышленности, при переработке растительных и животных жиров, являющихся глицеридами высших жирных кислот.
Глицерин в основном используют для производства тринитроглицерина и глифталевых смол (глифталей). Глифтали характеризуются высокой теплостойкостью, неплавкостыо и хорошими диэлектрическими свойствами,
их широко применяют в производстве слюдяной изоля-
ции — так называемых миканитов.
Глицерин широко применяют в парфюмерной промышленности, а также в ликеро-водочной, поскольку обладает сладковатым вкусом и большой вязкостью.
Простые эфиры. Простыми эфирами называют органические вещества, молекулы которых состоят из двух углеводородных радикалов, соединенных атомом кислорода
С2Н5—О—С2Н5 - диэтиловый эфир
СН3—О—С3Н7 метиллропиловый эфир
С2Н5-О—С3Н7 этилпропиловый эфир
Диэтиловый эфир. Физические и химические свойства. Диэтиловый эфир (называемый также серным и медицинским) представляет собой – бесцветную подвижную жидкость с температурой кипения 35,6 °С, замерзания 117°С. Эфир плохо растворим в воде (один объем эфира растворяется в 10 объемах воды), легче воды (плотность по отношению к воде составляет 0,714) и имеет специфический запах. Диэтиловый эфир чрезвычайно склонен к электризации. Разряды статического электричества могут возникнуть особенно в момент переливания или слива эфира и послужить причиной его воспламенения. Пары эфира почти в 2,5 раза тяжелее воздуха и образуют с ним взрывчатые смеси. Концентрационные пределы воспламенения: НПВ— 1,7%, ВПВ — 49,0%. При работе с эфиром надо всегда помнить, что его пары могут распространяться на значительные расстояния, сохраняя при этом способность к горению. Поэтому основной мерой предосторожности при обращении с эфиром является удаление его от открытого огня или других каких бы то ни было источников воспламенения.
Температура вспышки диэтилового эфира — 45 °С, а температура самовоспламенения 164°С. При поджигании эфир горит синеватым пламенем с выделением большого количества тепла
(С2Н5)2О + 6О2 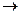 4С02 + 5Н2О + 2737 кДж
4С02 + 5Н2О + 2737 кДж
Эфир самовозгорается при контакте с сильными окислителями: хлором, озоном, перекисью натрия, азотной кислотой, со смесью перманганата калия и серной кислоты, хлората калия и серной кислоты.
Хранят диэтиловый эфир в стальных цистернах
или бочках либо в стеклянных бутылях темного цвета. Для удаления перекисей в эфир добавляют сульфат железа (II) FеSО4, который окисляется образующимися перекисями до Fе2(S04)з, а затем эфир отгоняют.
Получение и применение. Диэтиловый эфир получают из этилового спирта, нагревая последний в смеси с концентрированной серной кислотой.
Эфир является хорошим растворителем органических веществ, его применяют для извлечения масла из семян, для чистки тканей, как растворитель нитроклетчатки, при изготовлении порохов, коллодия.
 2014-02-02
2014-02-02 3247
3247








