Внутренняя энергия идеального газа целиком определяется кинетической энергией теплового движения молекул и зависит только от его температуры:

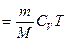 , (2.5.6)
, (2.5.6)
где  – молярная теплоемкость газа при постоянном объеме,
– молярная теплоемкость газа при постоянном объеме, 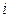 – число степеней свободы молекул газа.
– число степеней свободы молекул газа.
При вычислении внутренней энергии реальных газов необходимо также учитывать потенциальную энергию 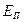 , обусловленную силами межмолекулярного взаимодействия
, обусловленную силами межмолекулярного взаимодействия
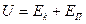 . (2.5.7)
. (2.5.7)
Силы молекулярного сцепления вызывают появление дополнительного внутреннего давления (2.5.2)  , а их работа приводит к изменению потенциальной энергии
, а их работа приводит к изменению потенциальной энергии

Проинтегрируем полученное выражение
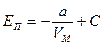 .
.
При безграничном увеличении объема расстояния между молекулами возрастают и потенциальную энергию следует принять равной нулю, поэтому и постоянная интегрирования 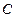 принимает нулевое значение (
принимает нулевое значение ( ).
).
Складывая кинетическую и потенциальную энергии, получим, что, внутренняя энергия реального газа зависит от его температуры 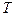 и объема
и объема  :
:
 . (2.5.8)
. (2.5.8)
Из первого закона термодинамики (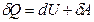 ) следует, что при адиабатном расширении газа (
) следует, что при адиабатном расширении газа (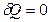 ) без совершения работы (
) без совершения работы (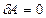 ) (расширение газа в вакуум)
) (расширение газа в вакуум)
 и
и 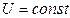 .
.
внутренняя энергия газа не изменяется.
Это равенство формально справедливо, как для идеального, так и для реального газов, но его физический смысл для обоих случаев различен.
Для идеального газа равенство 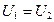 означает равенство температур (
означает равенство температур ( ), т. е. при адиабатном расширении идеального газа в вакуум его температура не изменяется.
), т. е. при адиабатном расширении идеального газа в вакуум его температура не изменяется.
Из уравнения (2.5.8) следует, что внутренняя энергия реального газа не изменится, если адиабатное изменение его объема будет сопровождаться изменением температуры газа, причем 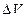 и
и 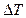 будут иметь разные знаки.Следовательно, при адиабатном расширенииреального газа в вакуум он охлаждается, а при адиабатном сжатии в вакуум – нагревается.
будут иметь разные знаки.Следовательно, при адиабатном расширенииреального газа в вакуум он охлаждается, а при адиабатном сжатии в вакуум – нагревается.
Контрольные вопросы:
1. Какие величины, которыми пренебрегают, рассматривая идеальные газы, учитывает уравнение Ван-дер-Ваальса?
2. От каких параметров состояния зависит внутренняя энергия ван-дер-ваальсовского газа?
3. Могут ли существовать в равновесии жидкая вода, ее пар и две кристаллические модификации льда?
Лекция № 5.
 2014-02-02
2014-02-02 2622
2622
