Физическую сущность выводов, полученных при анализе теоретических изотерм Ван-дер-Ваальса, можно выяснить при рассмотрении экспериментальных изотерм.
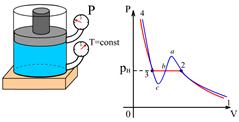 Рис.5.2 Рис.5.2 | На рис.5.2 приведены экспериментальная (красная) и теоретическая (синяя) изотермы. На участках 1-2 и 3-4 кривые совпадают. На участке 2-3 наблюдается различие. Эксперимент показывает, что на этом участке при уменьшении объема газа его давление не изменяется. Но в это время (уже в точке 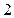 ) на стенках сосуда с газом начинает конденсироваться жидкость. В точке ) на стенках сосуда с газом начинает конденсироваться жидкость. В точке 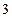 |
весь газ превращается в жидкость.
Следовательно, в условиях, соответствующих участку изотермы 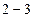 , наблюдается два агрегатных состояния вещества – газообразное и жидкое. Газ в этом случае называется насыщенным паром, а его давление – давлением насыщения
, наблюдается два агрегатных состояния вещества – газообразное и жидкое. Газ в этом случае называется насыщенным паром, а его давление – давлением насыщения  . Если на этом участке приостановить изменение объема, то процессы испарения и конденсации будут динамически уравновешены. При сжатии жидкости (участок
. Если на этом участке приостановить изменение объема, то процессы испарения и конденсации будут динамически уравновешены. При сжатии жидкости (участок 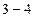 ) незначительное уменьшение ее объема приводит к большому увеличению давления, т. к. жидкость практически несжимаема.
) незначительное уменьшение ее объема приводит к большому увеличению давления, т. к. жидкость практически несжимаема.
 Рис.5.3 Рис.5.3 | Состояния, соответствующие участкам 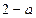 и и 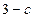 теоретической изотермы, при некоторых условиях практически осуществимы, но неустойчивы (метастабильны). Участок теоретической изотермы, при некоторых условиях практически осуществимы, но неустойчивы (метастабильны). Участок 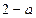 соответствует пару, находящемуся под давлением, большим, чем давление насыщенного пара при той же температуре. Он называется пересыщенным паром. Участок соответствует пару, находящемуся под давлением, большим, чем давление насыщенного пара при той же температуре. Он называется пересыщенным паром. Участок 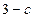 соответствует жидкости, находящейся под давлением, меньшим давления насыщенного пара при данной температуре Т. Это перегретая жидкость. соответствует жидкости, находящейся под давлением, меньшим давления насыщенного пара при данной температуре Т. Это перегретая жидкость. |
Если при различных температурах получить серию экспериментальных изотерм и соединить крайние точки их горизонтальных участков, то получится колоколообразная кривая. Эта кривая и участок критической изотермы, лежащей слева от точки перегиба 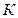 , делят (
, делят (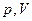 ) диаграмму на три области: область двухфазных состояний (под колоколообразной кривой), область жидкого состояния (слева) и область пара (справа). Выше критической изотермы находится газ, который никаким сжатием не может быть превращен в жидкость.
) диаграмму на три области: область двухфазных состояний (под колоколообразной кривой), область жидкого состояния (слева) и область пара (справа). Выше критической изотермы находится газ, который никаким сжатием не может быть превращен в жидкость.
Объем 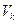 и давление
и давление 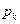 , соответствующие точке
, соответствующие точке 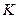 , называются критическими. Состояние с критическими параметрами:
, называются критическими. Состояние с критическими параметрами:
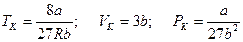 , (2.5.5)
, (2.5.5)
называется критическим (где а и b – поправки Ван-дер-Ваальса, 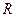 – молярная газовая постоянная).
– молярная газовая постоянная).
Таким образом, уравнение Ван-дер-Ваальса описывает газообразное состояние вещества, процесс перехода газа в жидкость и сжатие жидкости.
 2014-02-02
2014-02-02 741
741








