Молекулярно-Кинетическая теория (МКТ) идеальных газов
Параметрическая формула распределение Гольцмана.
Выведем закон изменения давления с высотой. Предположение, что поле тяготения однородно, температура постоянна, масса всех молекул одинакова p+dp, p+dh dh>0. Разность давлений p-(p+dp)=p(po)*gdh - весу газа, заключенного в объеме цилиндра.
dp=pdh pV=m/M*RT p=p/M*RT p=(pM)/RT
-dp=(pM)/RT*gdh
dp/p=(Mg)/(RT)*dh p2=p1*e(Mgh)/RT p=p0e(Mgh)/RT
nkT=nkT*eMgh/RT
Рассмотрим, что малярная масса будет
n=n0-(mNagh)/kNaT
mgh=П
n=n0e-ПкТ
Среднее число столкновений и средняя длина свободного пробега молекул
Между двумя последовательными столкновениями, молекулы проходят некоторый путь, который называется длинной свободного пробега молекул. Так как число молекул велико, длина свободного числа молекул будут различны. <l>=<v>/z, z-среднее число столкновений, испытываемой одной молекулой газа за одну секунду. Минимальное расстояние, на которое сближаются центры двух молекул, называется эффективным диаметром молекул.
Молекулярная физика – это раздел физики, изучающий строение и свойства веществ исходя из молекулярно-кинетического представления, основывающийся на том, что все тела состоят из молекул, находящиеся в непрерывном хаотическом движении.
Законы поведения огромного числа молекул изучаются с помощью статистического метода. Этот метод основан на том, что все свойства молекулярно-кинетической систем определяется свойствами частиц системы, особенностями их движения и усредненными значениями динамических характеристик (энергия и скорость) этих частиц.
В МКТ пользуются идеализированной моделью идеального газа, согласно которой считают, что:
· Собственный объем идеального газа пренебрежимо мал по сравнению с объемом сосуда
· Между молекулами газа отсутствуют силы взаимодействия
· Столкновение молекул газа между собой и со стенками сосуда абсолютно упругие
Рассмотрим закон, описывающий поведение идеальных газов.
Для каждой масс газа при постоянной температуре, произведение объема на давление постоянно. T=const, pV=const, m=const.
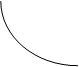
 Кривая изображает зависимость между p и V характеризующими свойства вещества при постоянной температуре называется Изотермой, а процесс – изотермическим.
Кривая изображает зависимость между p и V характеризующими свойства вещества при постоянной температуре называется Изотермой, а процесс – изотермическим.
 P
P
 T2
T2
T1
V
 2014-02-02
2014-02-02 673
673








