Энтропия идеального кристалла при абсолютном нуле температуры равна нулю.
При температурах, близких к абсолютному нулю, теплоемкость системы равна нулю.
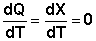 (3.27)
(3.27)
Одной из формулировок третьего начала термодинамики является также постулат Планка:
Строго говоря, тепловая теорема Нернста и постулат Планка являются следствиями из второго начала термодинамики; но независимо от этого они имеют очень большое значение, позволяя рассчитывать абсолютную энтропию системы и, следовательно, величину свободной энергии системы.
Рассчитаем изменение энтропии некоторой системы при нагревании её от абсолютного нуля до температуры T при постоянном давлении. Из первого и второго начал термодинамики имеем:
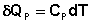 (3.28)
(3.28)
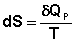 (3.29)
(3.29)
Отсюда:
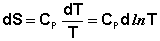 (3.30)
(3.30)
Учитывая, что ST=0 = 0, получим:
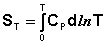 (3.30)
(3.30)
При T = 0 любое вещество может находиться только в твердом состоянии. При нагревании вещества возможен его переход в жидкое и затем в газообразное состояние; для фазовых переходов, происходящих в изобарно-изотермических условиях, изменение энтропии равно приведенной теплоте фазового перехода:
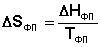 (3.31)
(3.31)
Таким образом, нагревание вещества без фазовых переходов сопровождается непрерывным ростом энтропии; при фазовом переходе происходит скачкообразное изменение энтропии. Графическая зависимость энтропии вещества от температуры приведена на рисунке 3.3.
Учитывая это, рассчитать абсолютную энтропию любого вещества при любой температуре можно следующим образом:
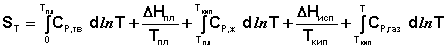 (3.32)
(3.32)
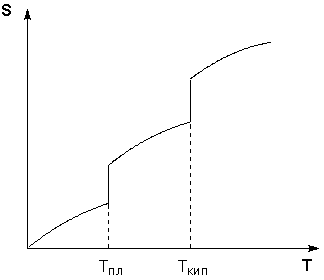
Рис. 3.3 Зависимость энтропии вещества от температуры.
Поскольку энтропия есть функция состояния, изменение энтропии в ходе химического процесса определяется только видом и состоянием исходных веществ и продуктов реакции и не зависит от пути реакции; оно может быть рассчитано по уравнению (I.67):
 (3.33)
(3.33)
Для многих веществ величины абсолютной энтропии в стандартных условиях приведены в справочной литературе.
 2014-02-02
2014-02-02 3453
3453
