Термин «энтропия» был введен Р. Клаузиусом в 1865г. Энтропия также является функцией состояния
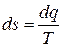 .
.
Это выражение при равновесном изменении состояния газа есть полный дифференциал некоторой функции состояния. Энтропия обозначается для 1 кг газа через s и измеряется в Дж/(кг∙К). Для произвольного количества газа энтропия, равна S=Мs и измеряется в Дж/К.
Формула справедлива как для идеальных газов, так и для реальных тел.
Подобно любой другой функции состояния энтропия может быть представлена в виде функции любых двух параметров состояния:
S=F(Р,V); S=F(Р,T); S=F(V,T).
При температурах, близких к абсолютному нулю, все известные вещества находятся в конденсированном состоянии. В. Нернст (1906г.) экспериментально установил, а М. Планк (1912 г.) окончательно сформулировал следующий принцип: при температуре, стремящейся к абсолютному нулю, энтропия вещества, находящегося в конденсированном состоянии с упорядоченной кристаллической структурой, стремится к нулю,
т.е. Sо= 0 при T = ОК. Этот закон называют третьим законом термодинамики или тепловой теоремой Нернста. Он позволяет рассчитать абсолютное значение энтропии в отличие от внутренней энергии и энтальпии.
Аналитически значение энтропии для заданного состояния определяется интегрированием уравнения:
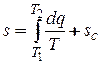 ,
,
где sC — константа интегрирования.
Поделив все члены уравнения первой формы первого закона термодинамики на Т, получим
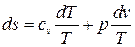
и, проинтегрировав, получим
s2 – s1 = 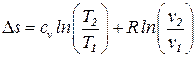 .
.
Энтропия применяется для расчёта неравновесных процессов, к которым относятся все процессы в реальных машинах. Это процессы, сопровождающиеся трением поршня или вихреобразованием в газе, или теплоотдачей в стенки. Неравновесность всегда приводит к росту энтропии, т.е. энтропия является мерой потерь или неравновесности. Поскольку в выражении энтропии температура находится в знаменателе, а потери сопровождаются снижением температуры, то в реальных неравновесных процессах энтропия увеличивается.
 2014-02-09
2014-02-09 610
610








