Второе начало термодинамики устанавливает возможен или невозможен при данных условиях тот или иной процесс, до какого предела он может протекать и какая наибольшая полезная работа (Аmax) совершается при этом.
Всякая тепловая машина, в том числе и химическая, может производить работу только при наличии разности температур между теплоотдатчиком Т1 и теплоприёмником Т2. Если обозначить количество теплоты, поглощённое рабочим телом от теплоотдатчика как q1, а количество теплоты, отданное телу с более низкой температурой (теплоприёмнику) как q2, то в работу превращается разность этих теплот:
А = q1 - q2.
Отношение количества произведённой работы А, к количеству Q1 называется термическим коэффициентом полезного действия (КПД) тепловой машины
η 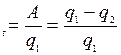 ,
,
из термодинамического цикла Карно вытекает, что:
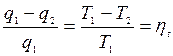 .
.
Из этого видно, что КПД такой машины зависит действительно только от температур теплоотдатчика и теплоприемника.
Так как по условию Т1 > Т2, то величина отношения 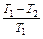 может иметь различные значения между нулем и единицей. Наиболее эффективной работа машины была бы, если было бы возможно иметь теплоприемник с температурой Т2 = 0. В этом случае было бы η = 1. Однако это практически невозможно, и чем выше температуры теплоприемника и, следовательно, чем меньше отношение
может иметь различные значения между нулем и единицей. Наиболее эффективной работа машины была бы, если было бы возможно иметь теплоприемник с температурой Т2 = 0. В этом случае было бы η = 1. Однако это практически невозможно, и чем выше температуры теплоприемника и, следовательно, чем меньше отношение 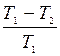 , тем меньше будет и коэффициент полезного действия машины. В пределе, если температуры Т1 и Т2 станут различаться ничтожно мало, то и к. п. д. будет тоже ничтожно малым.
, тем меньше будет и коэффициент полезного действия машины. В пределе, если температуры Т1 и Т2 станут различаться ничтожно мало, то и к. п. д. будет тоже ничтожно малым.
Полученный вывод относится к частному случаю работы идеальной тепловой машины, работающей по термодинамическому циклу Карно, состоящего из двух изотермических и двух адиабатных процессов. Рабочим телом такой машины является идеальный газ. На основании этого можно утверждать, что
1) даже для наиболее совершенной машины существует предел превращения теплоты в работу.
2) теплота, получаемая от теплоотдатчика, может быть превращена в работу тем в большей степени, чем больше различие в температурах теплоотдатчика и теплоприемника.
3) если нет разности температур, то процесс превращения теплоты в работу не может быть осуществлен.
Выражение для КПД можно преобразовать к виду
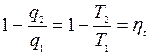
или
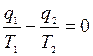 ;
;
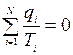
Т.е. для любого обратимого цикла сумма приведённых теплот q i /T i равна нулю. Данную сумму можно представить в виде интеграла по замкнутому контуру:
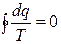
Если интеграл по замкнутому контуру равен нулю, то подынтегральное выражение есть полный дифференциал некоторой функции. Эту функцию и называют энтропией. Она, как и внутренняя энергия, является функцией состояния системы
|
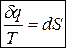
для необратимых процессов 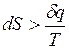 ;
;
в общем случае 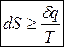 .
.
Для изолированных систем d q = 0, поэтому для них dS > 0. В условиях равновесия dS = 0.
Таким образом, энтропия является искомым критерием, определяющим возможность, направление и предел протекания самопроизвольных процессов в изолированных системах.
Подставим в уравнение первого начала термодинамики TdS вместо d q, в результате получим уравнение
TdS = dU + dA,
которое является объединенным уравнением первого и второго начала термодинамики для обратимых процессов, которое называют также фундаментальным уравнением термодинамики.
Введём в это уравнение энтальпию
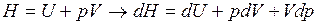 .
.
Подставляя dH вместо dU, имеем
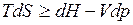
Отсюда для обратимых процессов: 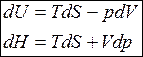
Для необратимых процессов можно записать следующим образом:
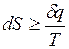

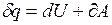
Отсюда 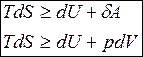
10. Вычисление ∆S в различных процессах (фазовые превращения, нагревание, расширение (сжатие) идеального газа)
Для изотермического процесса (T = const)
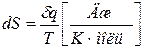
в частном случае для фазового перехода (испарение, плавление …)
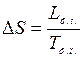 ,
,
где L ф.п – теплота фазового перехода; T ф.п. – температура фазового перехода;
Для изотермического расширения газа
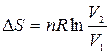 или
или 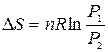
Для неизотермических процессов (T ¹ const)
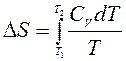
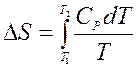
обычно расчёт ведут от стандартной температуры Т1 = 298 0К:
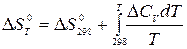 ,
,
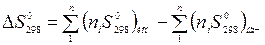 .
.
Для точных расчётов в подинтегральное выражение подставляют зависимость теплоёмкости от температуры DCV = f (T).
Если в системе идёт несколько последовательных процессов, то общее изменение энтропии равно сумме изменений энтропии в каждом отдельном процессе
DS = DS1 + DS2 + …
В общем случае
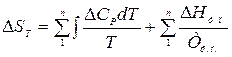 ,
,
где первая сумма выражает изменение энтропии в процессе нагревания или охлаждения, вторая сумма – изменение энтропии при фазовых переходах.
11. Постулат Планка. Абсолютное значение энтропии. Вычисление ∆S в химической реакции
При интегрировании дифференциальных уравнений, рассматриваемых первым и вторым началом термодинамики, появляются константы интегрирования, которые в ряде случаев на основании двух начал термодинамики теоретически неопределимы.
Эта задача решается с помощью третьего начала или тепловой теоремы Нернста (1906): при стремлении температуры к абсолютному нулю энтропия системы стремится к нулю при прочих фиксированных условиях (напр. - при неизменных объеме или давлении)
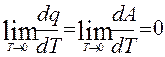
Тепловая теорема имеет следствия, из которых наиболее важным в расчетном отношении для конденсированных систем является постулат Планка: энтропия чистых твёрдых веществ, образующих идеальные кристаллы, при абсолютном нуле равна нулю S0 = 0.
Из уравнений первого и второго начал термодинамики
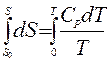 ,
,
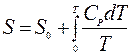 .
.
Поскольку S0 = 0, то
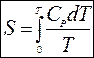
Это уравнение дает возможность расчета абсолютных значений энтропии, необходимо лишь, чтобы зависимость теплоемкости от температуры была задана теоретическим уравнением (по квантовой теории). Применение зависимости в степенного ряда допустимо лишь при расчете изменений энтропии в неизотермическом процессе в области температур порядка 00С и выше.
Вычисленные значения абсолютных энтропии веществ при стандартной температуре 2980К в виде S0298 приведены в справочнике физико-химических величин.
Энтропия является единственной характеристической функцией, для которой известны абсолютные значения, так как для других функций неизвестны нулевые составляющие. Знание абсолютных энтропий значительно облегчает многие термодинамические расчеты. Так, если для любой реакции известны стандартные энтропии конечных продуктов и исходных веществ, стандартное изменение энтропии в реакции
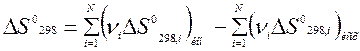
 2014-05-17
2014-05-17 9840
9840
