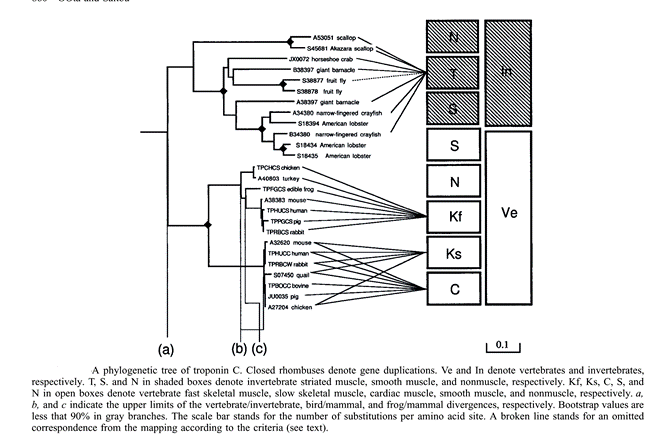
Рис. 2.4.11. Филогенез тропонина С
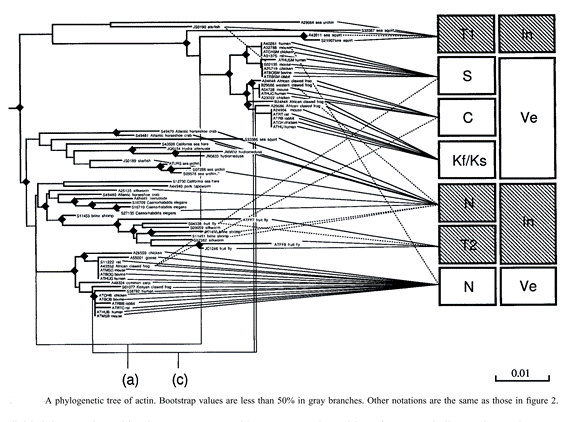
Рис. 2.4.10. Филогенез актина позвоночных и беспозвоночных животных
Рис.2.4.9.Строение участка актиновой фибриллы.
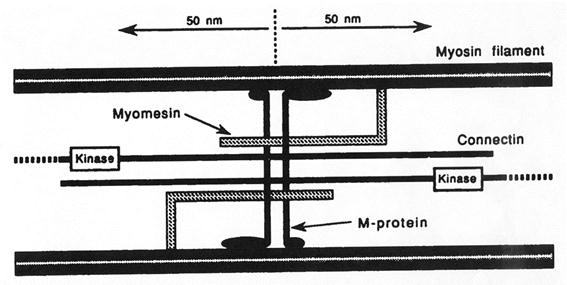
Рис. 2.4.8. Строение М-линии
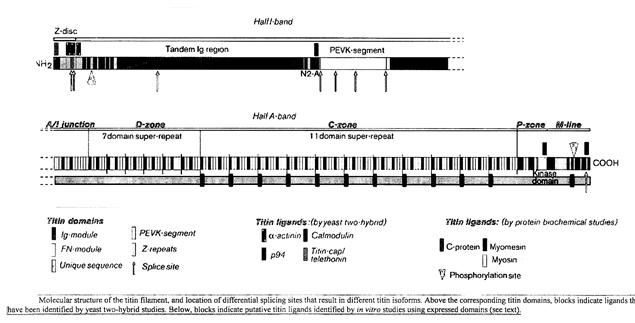
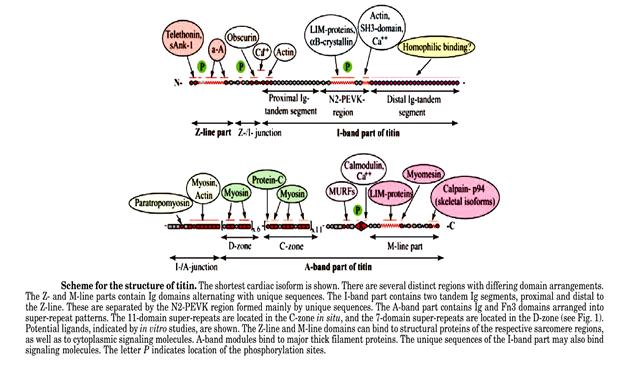
Рис.2.4.7.Структура молекулы титина
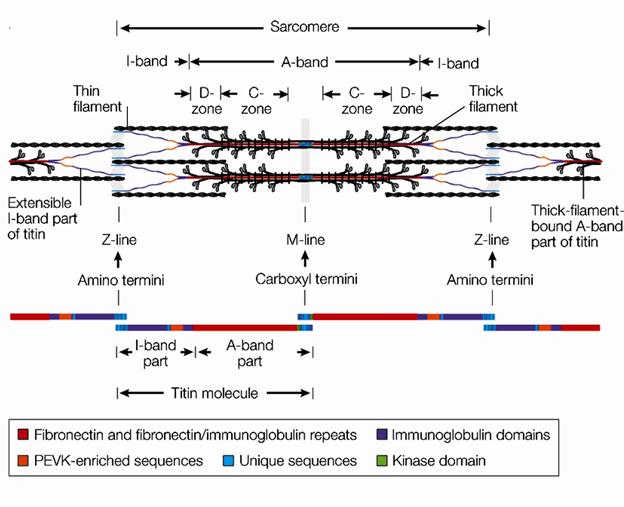
Рис. 2.4.6. Расположение молекул титина и его доменов в саркомере
Рис. 2.4.4. Филогенез легких регуляторных цепей миозина
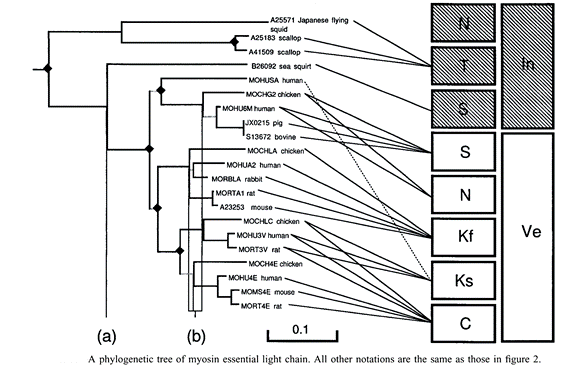
Рис. 2.4.5. Филогенез легких щелочных цепей миозина (по:
Не - миозиновые компоненты толстых фибрилл:
В состав миозиновых фибрилл входит большое число вспомогательных белков, которые принимают участие в образовании структуры саркомера, регуляции процесса сокращения и расслабления и др. Часть этих белков изучена достаточно хорошо, другие обнаружены недавно и их функции изучаются:
Титин (коннектин) - один из самых крупных белков нашего организма. МВ – от 200 до 4000 KD.
Имеет очень сложную доменную структуру:
Ig домены (300 копий) локализованы в А-диске (160 копий) и в I диске
Fn 3 домены (300 копий) в А-диске и I- диске
Сайты фосфолирирования. Около С и N концов титиновой молекулы
(С-конец в Z- диске, N – конец в М-линии)
Киназные домены. В районе М-линии, фосфолирируют один из белков
М-линии – телетонин
Эластические участки молекулы, соединяющие миозиновые
фибриллы с Z – диском.
Функции титина:
Направляет (структурирует) сократимые элементы саркомера
Обеспечивает эластичность миофибриллы в процессе сокращения и
растяжения
С – белок - МВ – 140 KВ
Расположен в первой трети с каждой стороны А-диска
Соединяет хвосты миозиновых молекул (от 200 до 400 шт) в фибриллу
М- линия
Содержит три белка: креатин киназу, М-белок (165 KD), миомезин (190 KD)
Тонкие (актиновые) филаменты
Один из наиболее распространенных белков в клетке. Является элементом цитоскелета – микрофиламенты.
В мышце входит в состав саркомера.
Актиновый филамент:
Содержит примерно 360 актиновых молекул
Образует двойную спираль
Стабилизируется в Z - дисках с помощью α - актинина
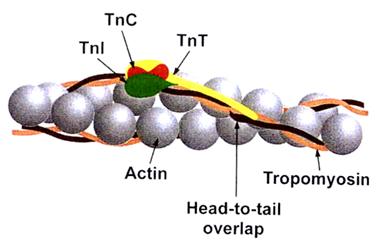
С актином тесно связаны два важнейших регуляторных белка: тропонин и тропомиозин.
Тропонин:
Комплекс из трех глобулярных белков.
TNN-I
Разновидности: в скелетных мышцах – медленный TNNI -1
быстрый TNNI -2
в сердечных TNNI 3
Функция: подавляет актин-миозиновые взаимодействия
TN-C субъединица тропонина, связывающаяся с ионами Са (два иона на молекулу)
TN – T
Разновидности: в скелетных мышцах – медленный TNNT -1
быстрый TNNT -3
в сердечных TNNT -2-
Функция: связывается с тропомиозином
Тропомиозин (TM).
Фибриллярный белок из двух α-цепей, состоящих из α и βсубъединиц.
Функция: обеспечивает тропонин и Са–зависимое мышечное сокращение, открывая или закрывая активные центры актин-миозинового взаимодействия.
Каждая молекула тропомиозина контактирует с 7 молекулами глобулярного актина

Профилин – взаимодействует с актином в соотношении 1:1.
Способствует полимеризации (при низкой концентрации) и деполимеризации (при высокой концентрации) актина
Разновидности: профилин - 1 (во всех клетках)
профилин - 2(в мышцах, клетках мозга и почки)
Кофилин -2 – расположен на тонком филаменте, взаимодействует с актином через влияние на тропомиозин.
Структурные, вспомогательные белки, связанные с актиновыми филаментами:
Небулин – МВ 600-800 KD, 3-4% белков миофибрилл, состоит из 185 копий цепочек из 35- 40 АК.
Функции: вероятно является структурной (скелетной) основой для актиновых филаментов, располагаясь вдоль всей длины актиновой фибриллы по две молекулы на фибриллу.
В гладких мышцах есть также особые кальцийсвязывающие белки, связанные с актиновыми филаментами (см. лекцию Гладкая мускулатура).
 2014-02-02
2014-02-02 1438
1438








