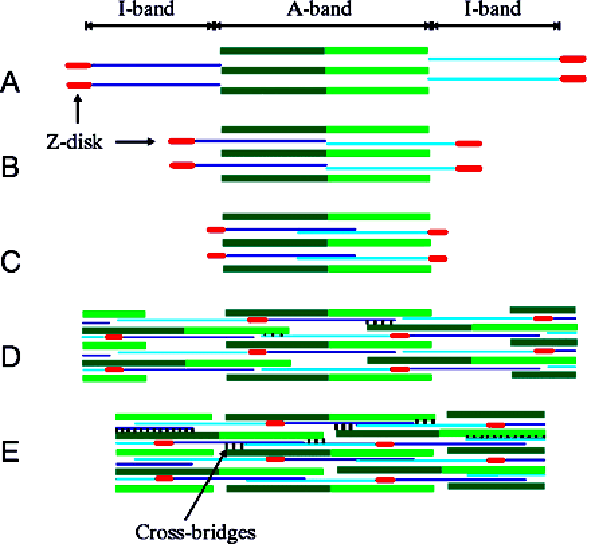
Рис. 2.4.19. Схема состояния сократимых фибрилл саркомера при нормальном (В,С) и суперсокращении (D,E)скелетной мышцы.
Рис. 2.4.12. Структура Z- диска и ряд белков, входящих в его состав.
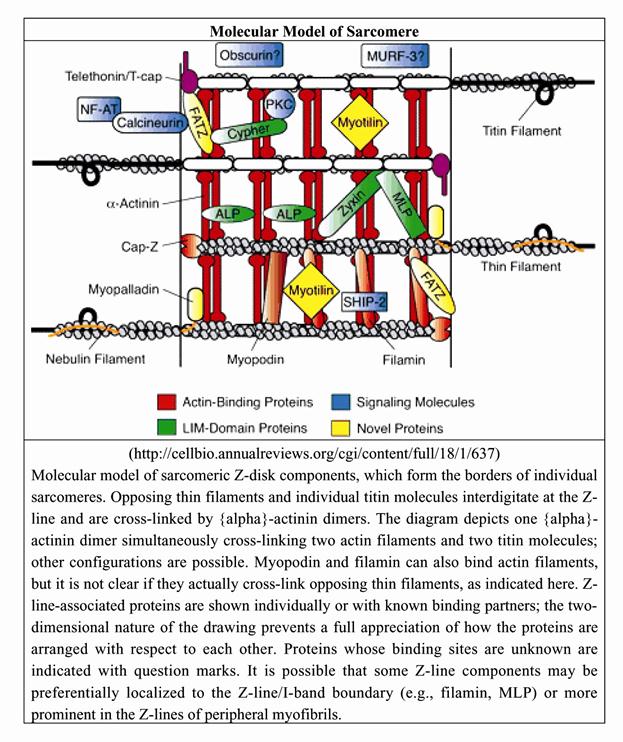
Рис. 2.4.13. Одна из современных схем строения Z – диска (по: E.Niederhoffer, Muscle biochemistry, 2004)
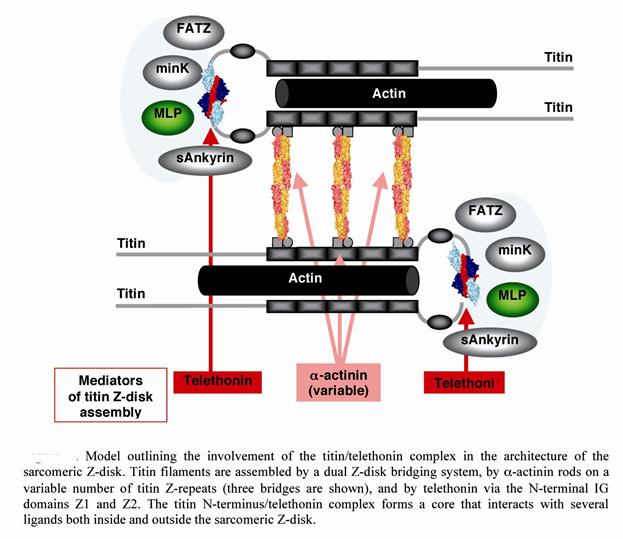
Рис. 2.4.14. Схема взаимодействия актиновых филаментов с титином и рядом белков саркомера в районе Z – диска (по:PejianZou et all., 2006)
Костамеры – система цитоскелетных белков, образующих поперечный и продольный каркас вокруг миофибриллы. Костамеры обеспечивают жесткость всей системы миофибриллы, связывая ее с сарколеммой.
В состав костамеров входит большое число белков: ацикулин, γ-актин, α - актинин. анкирин, коллагены IV и XII типов, десмин, дистрогликан, дистрофин, интегрины α7, и β1, ламинин-1, мелузин, равен-1, спектрин, синкоилин, синтрофин, Е-тропомодулин, виментин, винкулин, талин. и ряд других белков.
Большое количество белков с разными названиями, возможно, свидетельствует, с одной стороны, о сложности строения этой структуры мышечного волокна и, с другой, об интенсивных исследованиях в этой области миологии и возможном дублировании исследований и отсутствия унифицированной классификации белков костамеров и саркомеров.
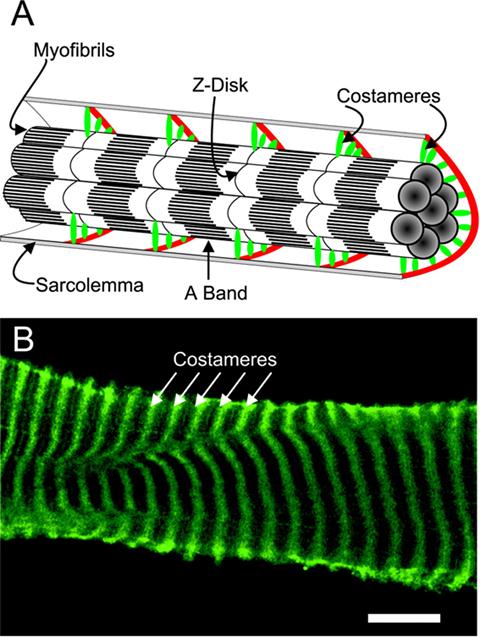
Рис. 2.4.15. Схема строения и иммуногистохимия (конфокальная оптика) костамеров скелетного мышечного волокна (по:Ervasti, 2003)
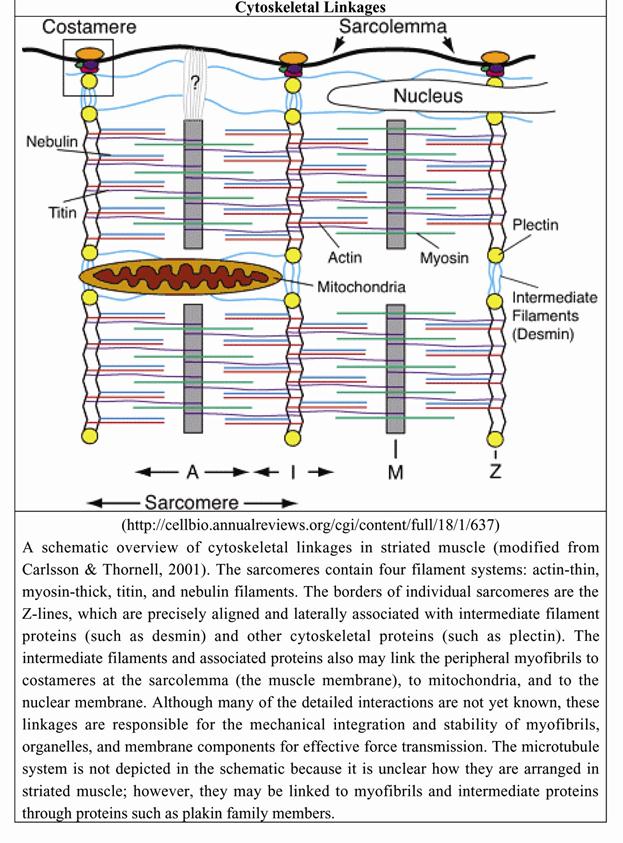
Рис. 2.4.16. Структура и состав цитоскелетных компонентов мышечного волокна и система костамеров (по: E.Niederhoffer, Muscle biochemistry, 2004, South Illinois University Press)
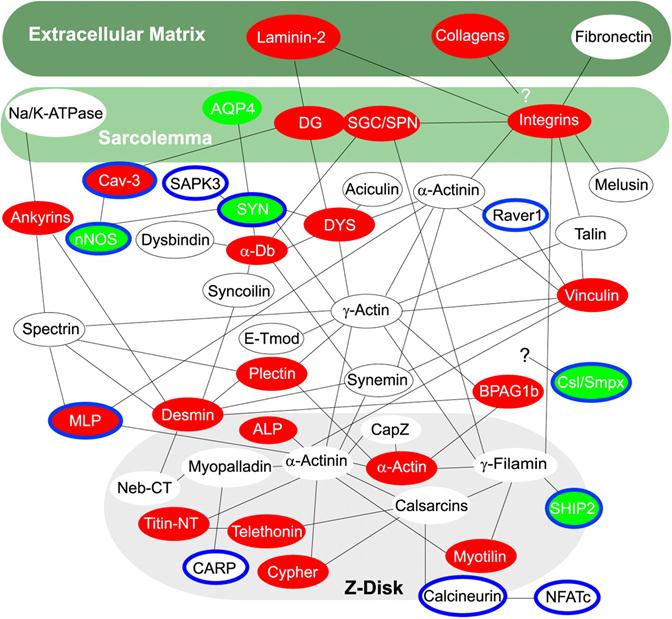
Рис. 2.4.17 Основные белки, входящие в состав костамеров, их связь с сароклеммой и Z - диском (по:Ervasti, 2003).

Рис. 2.4.18. Конфокальная микроскопия иммуногистохимиии ряда белков, входящих в состав костамеров (по:Ervasti, 2003).
Вопрос развития тканей в онтогенезе или восстановления тканей в процессе развития или повреждения – важнейший вопрос гистологии конкретной ткани, в том числе и мышечной
Понятие камбий пришло в гистологию из ботаники и крупнейшим специалистом в вопросе определения понятия камбиальности тканей был акад А.А.Заварзин
«камбиальнгые клетки – это клетки в составе дефинитивных тканей, сохранившие потенции к размножению и дифференцировке, в том числе и к дивергентной, но в пределах определенного тканевого типа»
Миогенез соматической мышечной ткани
Большой вклад в изучение миогенезе внесли работы отечественных гистологов: Н.Г. Хлопина, А.А.Заварзина, П.П.Румянцева, А.А.Клишова, Р.К.Данилова и др.)
Выделяют несколько стадий миогистогенеза:
- миобластическую (клеточную)
- миосимпластическую
- стадия миотуб (мышечные трубочки, миотубулы)
- молодые и зрелые мышечные волокна
Поперечно- полосатая мускулатура образуется из миогенных стволовых клеток мезенхимного происхождения.
Однако пути развития клеточной и симпластической популяций в процессе развития мышечных волокон различен.
Клеточный компонент – миосаттелиты – одноядерные малодифференцированные клетки, расположенные под базальной мембраной мышечного волокна, способные к митозу и участвующие в обновлении волокна и их новообразовании при регенерации путем их слияния с волокнами на разных стадиях гистогенеза.
Выделяют два типа милосаттелитов
1- тип – более дифференцированные клетки с активным ядром, узким ободком ципоплазмы
2 – тип –коммитированные полустволовые клетки (промиобласты). Именно эта популяция миосаттелитов и является источником обоих компонентов мышечного волокна и составляют пролиферативный пул волокна.
Проимиобласты формируют клоны первых терминально дифференцированных клеток – инициальных миобластов, которые становятся центрами формирования первых миосимпластов. Неспособные к м итозу инициальные миобласты легко сливаются друг с другом и образуют сначала симпласты, затем миотубы, затем волокно.
С появлением первых симпластов и миотуб, вблизи них появляются одноядерные клетки, представленные другим клоном проимиобластов, направленным на формирование клеток – саттелитов
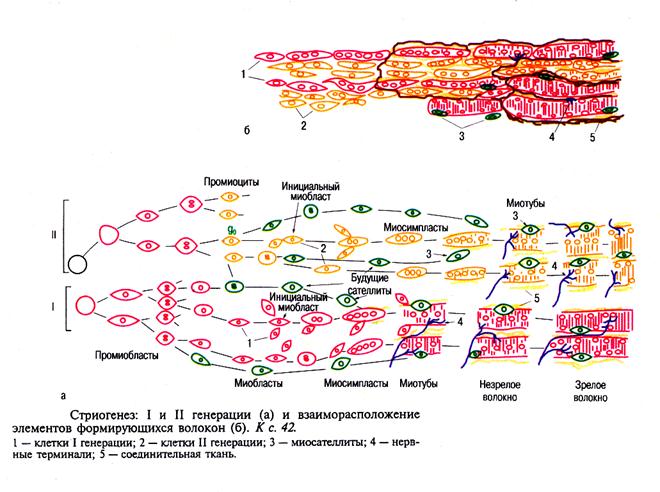
Так образуется ПЕРВАЯ ГЕНЕРАЦИЯ мышечных волокон, сформированная при участии инициальных миобластов. Они
Одновременно начинает формироваться ВТОРАЯ ГЕНЕРАЦИЯ волокон из проомиоцитов. Они находились в состоянии пролиферативного покоя (стадия G0). Они проникают между соседними первичными миотубами, сливаются, удлиняются и образуют вторичные миотубы.
Первоначально миотубы располагаются в виде пучков. Окруженных общей соединительно тканной оболочкой. Далее происходит разделение миосимпластов и каждый из них покрывается базальной мембраной и эндомизием. Тогда же появляются первые синапсы.
Возникновение контактов с моторными нейронами является критическим этапом миогенеза. После этого наступает этап
Вторичная генерация миотуб отделяется при этом от первичной, образуя самостоятельные единицы сокращения – мышечные волокна.
Утановлено, что первичная генерация миосимпластов образует медленные мышечные волокна, тогда как втоичные – быстрые мышечные волокна. Они, как отмечалось выше, значительно отличаются друг от друга по ряду параметров (см. табл. ХХ).
В результате эмбрионального миогистогенеза из стволовых клеток миотома сегментированной мезодермы путем дивергентной дифференцировки развиваются два взаимодействующих между собой дифферона: камбиальный и симпластический, которые формируются параллельно и определяют в постнатальном периоде репаративные свойства
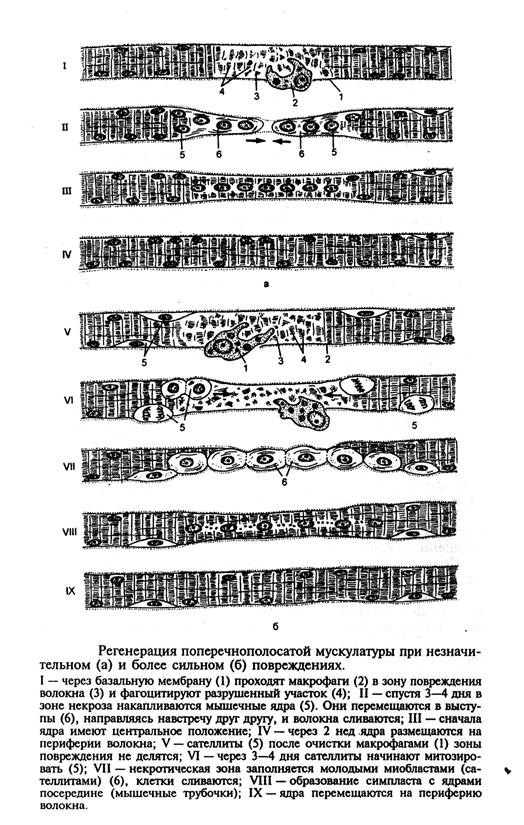
Первый дифферон представлен миосателлитоцитами, впервые описанными A. Mauro (1961), развивающимися из промиоцитов, локализуюется между базальной пластинкой и сарколеммой мышечных волокон и является морфофункциональной основой камбиального резерва тканевой системы скелетной мышцы. В постнатальном периоде активная пролиферация миосателлитоцитов определяется уже к третьему дню после повреждения ткани. После серии митозов в посттравматическом рабдомиогенезе из них формируется популяция миобластов, которые, сливаясь, образуют новые мышечные симпласты..
Симпластический дифферон также участвует в репаративной регенерации: вблизи линии разрыва волокна делятся ядра, симпласты колбообразно утолщаются с формированием «мышечных почек», растущих по направлению друг к другу с тенденцией к слиянию [ Однако вопрос о механизмах репаративной регенерации мышечных симпластов до настоящего времени остается дискуссионным. Это связано с появлением данных о возможности реализации репаративного процесса за счет клеток, образующихся посредством отделения ядросодержащей части симпластов.
Авторы с использованием биолюминисцентного метода привели доказательства, позволяющие предположить, что гетерогенная популяция сателлитоцитов включает истинно стволовые клетки, способные к долгосрочной пролиферации и дифференцировке в миогенном направлении. Разработка высокоселективных методов их получения может послужить основой для дальнейшего применения в рамках клеточной терапии для лечения пациентов с повреждениями мышечной системы.
[2].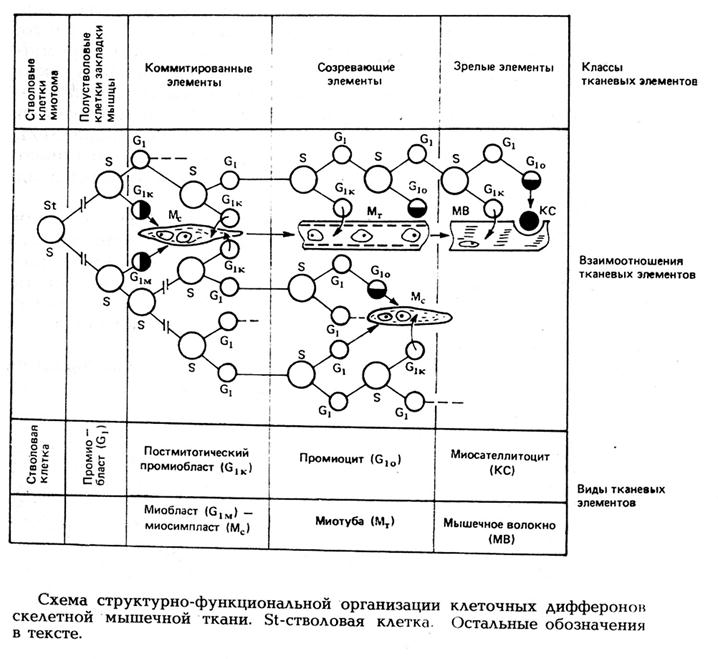
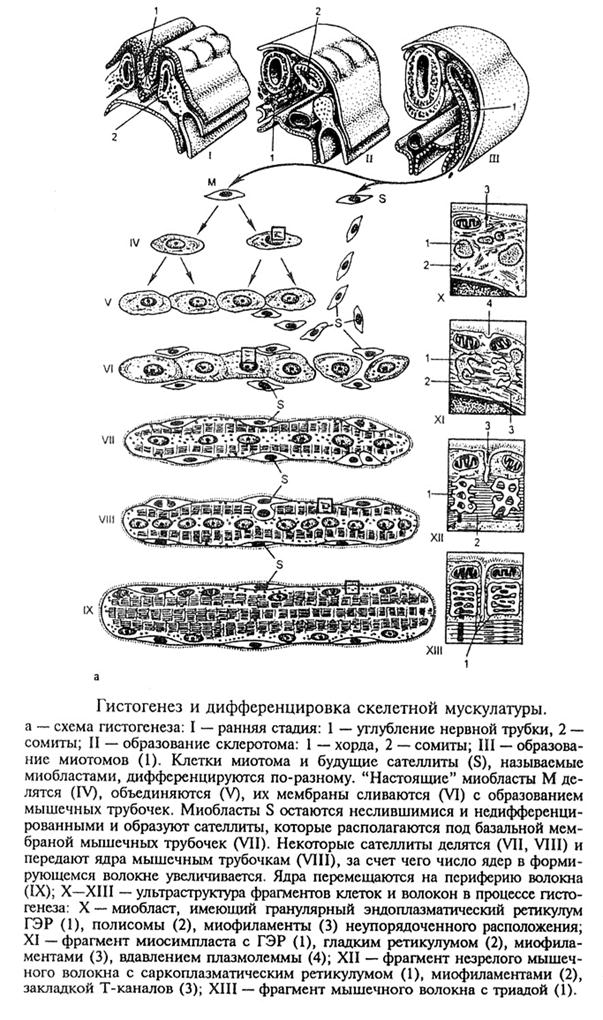
Регенерация скелетных мышц
Источником регенерации мышечного волокна как в случае физиологической, так и репаративной регенерации служат миосаттелиты.
Условиями регенерации мышц являются:
- натяжение, уставновление связей со скелетом посредством связок и сухожилий
- восстановление кровоснабжения
- установление нервной связи
Стимулом к вступлению миосаттелитов в цикл размножения и дифференцировки являются митогены, комплекс биологически активных веществ, находящихся в цитоплазме мышечного волокна, а также нейротрофические субстанции, выделяемые из нервноых окончаний проросших к формирующейся новой миотубе аксонов. (если к моменту образования миотуб не образуется контакта с нервными волокнами – процесс регенерации останавливается и происходит распад мышечного волокна).
Атрофия мышечных волокон – возникающей вследствие гипокинезии, голодания или деиннервации – мышечные волокна истончаются, исчезает поперечная исчерченность, расщепляются мышечные волокна. Эндомизий разрастается, происходит замещение мышечной массы жировой тканью.
Есть наследственно обусловленные миоатрофии: амиотрофический латеральный склероз, злокачественна миастения.
Дистрофия – повреждается не вся мышца, а только ее часть. Возможна компенсация поврежденной ткани путем регенерации. Примером мышечной дистрофии (наследственной) – является мышечная дистофия Дюшена.
Некроз мышц – гибель мышечной ткани в результате прекращения кровоснабжения (инфаркт мышц), либо в результате ранения. Некроз часто сопровождается жировой дистофией или липоматозом – отложением жира в самой мышечной ткани.
Гипертрофия – наблюдается при тренировках, других нагрузках. Важно отметить, что при длительных тренировках, их резкое прекращение может привести к атрофическим изменениям в мышцах.
Регенерация скелетных мышц имеет важное клиническое значение при мышечных дистрофиях и различных травмах, и зависит от камбиального резерва, формируемого клетками-миосателлитами. Как формирующие скелетное мышечное волокно миобласты, так и клетки-миосателлиты образуются из единых мышечных предшественников с высоким пролиферативным потенциалом [2]. После завершения формирования мышечного волокна во время эмбрионального развития скелетной мышцы клетки-миосателлиты располагаются вне многоядерного волокна и остаются пролиферативно-неактивными. Выживание и распространение этих клеток основано на экспрессии транскрипционного фактора Pax7
Было показано, что в покоящихся клетках-миосателлитах наблюдается постоянная экспрессия Pax7
В опытах, проведенных в лаб эмбриологии Института Карнеги (США) было показано, что после травмы, вызванной кардиотоксином, у гетерозиготных по аллельным вариантам гена Pax7 (Pax7+/СЕ) мышей на 60-90 сутки после рождения все мышечные волокна, полученные в результате регенерации, оказались β-гал+. Это показывает, что основным источником регенерирующих волокон являются потомки клеток, экспрессирующих Pax7. Оказалось неожиданным, что и у мышей с полностью выключенным геном Pax7 миофибриллы регенерировали, причем в волокнах не было обнаружено ни мРНК Pax7, ни самого белка Pax7. Таким образом, функциональный белок Pax7 не требуется для регенерации скелетных мышц после травмы во взрослом возрасте.
У мутантов Pax7-/- в зародышевой линии, напротив, после травмы регенерировали лишь редкие тонкие волокна.
В результате оказалось, что регенерация мышечных фибрилл перестает быть зависимой от клеток-потомков Pax7+ предшественников после 21 суток постнатального развития. Именно на этом сроке развития завершается формирование «архитектурного облика» мышечного волокна, распределяются ядра, и обособляются молчащие клетки-миосателлиты
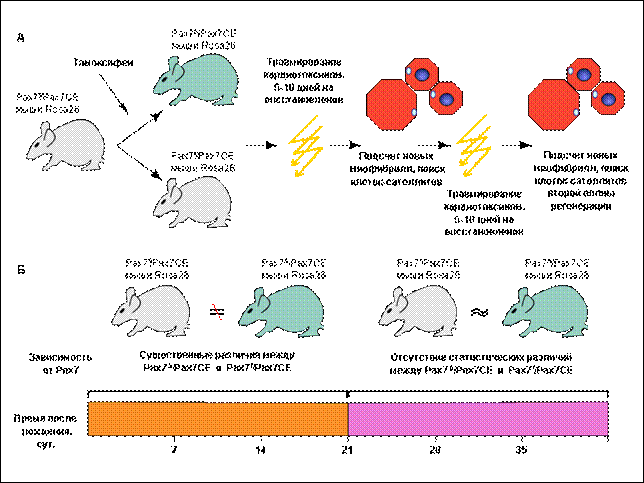
Результатами своего исследования авторы считают, в первую очередь, открытие факта, что белок Pax7 функционально не только координирует выживание и пролиферацию клеток-миосателлитов, но и предотвращает их дифференцировку и слияние в мышечное волокно, сохраняя потенциал к регенерации у клеток-миосателлитов. Также был определен критический период зависимости от Pax7 во время перехода от миосателлитоцитов к состоянию стволовых клеток, обеспечивающих скелетным мышцам способность к регенерации. Этот период у мышей заканчивается на 21 сутки после рождения. Показана неотъемлемая роль Pax3 и Pax7 для эмбриональных мышечных предшественников, и роль только одного Pax7 для перинатальных. Совершенно неожиданно оказалось, что взрослые клетки-сателлиты не нуждаются ни в Pax3, ни в Pax7 для осуществления процессов мышечной регенерации.
Авторы серьезно пошатнули господствующую концепцию о том, что «регенерация повторяет развитие». Изменения в генетической программе мышечных стволовых клеток при переходе от эмбриональной стадии к ювенильной и далее к стадии взрослого организма подталкивает к осторожности в применении знаний, полученных при эмбриональных исследованиях, к биологии стволовых клеток взрослых. Зависимые от возраста изменения в свойствах стволовых клеток убеждают в необходимости тщательного анализа возраста клеточного материала, используемого при трансплантациях в регенеративной медицине.
 2014-02-02
2014-02-02 6938
6938