Строения атома
Экспериментальные предпосылки квантовой теории
Химические свойства атомов определяются их электронными оболочками, поэтому химикам необходимо знать строение этих оболочек; это, в свою очередь, означает необходимость описания состояния электронов в атоме.
В основе квантовой теории электронного строения атома лежат рассматриваемые ниже экспериментальные данные.
Атомный спектр является важнейшей характеристикой атома и отражает его внутреннее строение.
Планетарная модель Резерфорда противоречила факту устойчивого существования атомов. В результате ускоренного движения электрона расходуется энергия его электростатического взаимодействия с ядром и, согласно расчетам, через 10-8 с электрон должен упасть на ядро. Согласно модели Резерфорда, энергия атома должна уменьшаться непрерывно за счет излучения, образующего сплошной спектр. Однако экспериментально установлено, что все атомные спектры имеют линейчатый (дискретный) характер. Атомные спектры многих элементов имеют очень сложную структуру. Например, спектр атома железа насчитывает свыше 5 тысяч линий. Наиболее простой спектр у атома водорода. В видимой области спектра атома водорода имеется только 4 линии. В прилегающей к видимой УФ-области имеется еще ряд линий, которые с первыми четырьмя объединяются в серию Бальмера, который обнаружил (1885 г.), что волновые числа (частоты n = 1/l) линий этой серии очень точно выражаются следующей закономерностью:
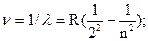
где R = 109678 cм-1 - константа Ридберга, n – целое число >2.
Из этого следует, что атом может находиться в нескольких (многих) энергетических состояниях, но они не непрерывны, а прерывисты, то есть квантованы. Переход из одного состояния в другое происходит скачком. При этом излучается или поглощается электромагнитное излучение определенной частоты и длины волны.
 2014-02-02
2014-02-02 3144
3144








