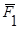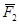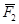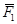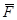Закон Дальтона.
Мал.1 Мал.2 Мал.3
Англійський фізик та хімік Дальтон, вивчаючи поведінку суміші газів, встановив, що тиск газової суміші дорівнює сумі парціальних тисків газів, що входять у суміш:
P = P1 + P2 + … + Pn
Парціальним тиском газу, що входить до газової суміші, називається тиск, який мав би газ, як би всі інші гази були випущені з об’єму посудини.
При однакових температурі і тиску молі будь-яких газів займають однакові об’єми.
При нормальних умовах цей об’єм дорівнює 22,42 х 10-3 м3/моль.
2. Рівняння Клапейрона, Менделєєва-Клапейрона, універсальна газова стала.
При вивченні експериментальних газових законів ми розглядали газові процеси, при яких одна з характеристик стану газу залишалась незмінною, а дві інші змінювались.
Розглянемо загальний випадок, коли одночасно змінюються об’єм, тиск та температура. Нехай стан деякої маси т газу характеризується параметрами:
V1 P1 T1
Переведемо її в іншій стан з параметрами
V2 P2 T2
Процес буде проходити двома етапами:
а) при сталій температурі (T1 = const) ізотермічно змінимо об'єм до V2, при цьому його тиск дорівнюватиме PI1
б) потім ізохорно (при V2 = const) змінимо температуру до значення Т2, при цьому тиск дорівнюватиме Р2.
Перший етап описується законом Бойля-Маріотта:
V1 P1 = V2 PI1, звідси 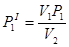
Другий етап можна описати законом Шарля:
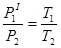 Підставимо сюди
Підставимо сюди 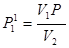
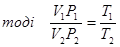 або
або 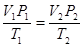
Таким чином, для даної маси газу величина 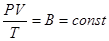 є незмінною. Цей закон був встановлен французським фізиком Клапейроном. Його ще називають об’єднаним газовим законом.
є незмінною. Цей закон був встановлен французським фізиком Клапейроном. Його ще називають об’єднаним газовим законом.
Недоліком рівняння Клапейрона є ті обставини, що величина В різна для різних газів. Менделєєв змінив цей закон, об’єднав його з законом Авогадро.
Розглянемо один моль газу, позначивши його об’єм через Vμ. Тоді рівняння Клапейрона для одного моля газу запишемо у вигляді:
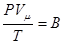
Згідно з законом Авогадро при однакових значеннях Р і Т молі усіх газів матимуть однакові значення Vμ, тобто стала В буде однакова для усіх газів. Позначимо це значення В через R. Тоді
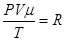
Це закон Менделєєва-Клапейрона для одного моля газу.
Так як об’єм газу пропорційний його масі при однакових Р та Т, то
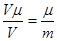 , де μ – маса моля газу, V – об’єм маси m цього газу.
, де μ – маса моля газу, V – об’єм маси m цього газу.
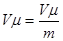
Підставимо 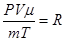 або
або
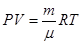 є
є
Це рівняння Менделєєва-Клапейрона для будь-якої маси газу. R – універсальна газова стала. Визначимо її з рівняння:
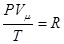
При цьому один моль газу знаходиться при нормальних умовах:
Р = 1 атм, Т=273К, Vμ=22,42 x 10-3 м3/моль, 1атм = 1,013х105 Н/м2.
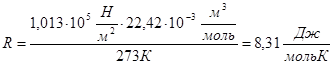
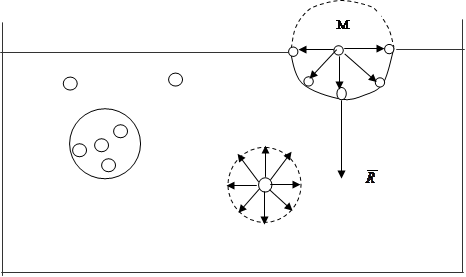
3. Середня кінетична енергія поступального руху молекули ідеального газу. Число Лошмідта.
Основне рівняння молекулярно-кінетичної теорії має вигляд:
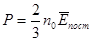
Обидві частини цього рівняння помножимо на об’єм одного моля газу Vμ:

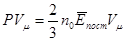 ,
,
n0Vμ=NA – число молекул в одному молі (число Авогадро).
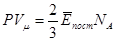
Згідно рівняння Менделєєва-Клапейрона для одного моля PVμ = RT, тоді
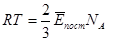
Звідси 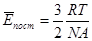 , позначимо
, позначимо 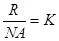 - стала Больцмана.
- стала Больцмана.
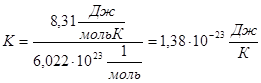
Тоді, 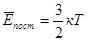
Таким чином, середня кінетична енергія поступального руху молекул ідеального газу пропорційна абсолютній температурі і залежить тількі від цієї температури.
Підставимо одержаний вираз в рівняння Клаузіуса. Тоді
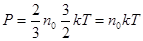
Звідси, 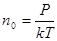
Таким чином, при однакових температурі та тиску всі гази містить в одиниці об’єму однакову кількість молекул. Число молекул, що містяться в одному метрі кубічному газу, при нормальних умовах називається числом Лошмідта.
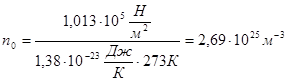
Визначимо `Епост при нормальних умовах:
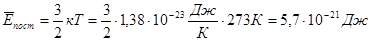
Питання та вправи для самоконтролю .
1. Які процеси називають ізопроцесами?
2. Як можна експериментально перевірити закони Бойля-Маріотта, Гей-Люссака, Шарля?
3. Накресліть, користуючить координатними осями Р,V, ізотерму, ізохору та ізобару.
4. Балон містить стиснений кисень при температурі 250С і тиску 1,5 х 107 Па. Під час газового зварювання витрачена половина кисню. Визначити, який тиск встановиться в балоні, якщо температура газу знизилась до 150С.
5. Тиск у кабіні космічного корабля при температурі 290К дорівнює 9,7 х 104 Па. Як зміниться тиск повітря при підвищенні температури на 8 К?
6. Сучасна техніка дає змогу створювати дуже високий вакуум, порядка 10-7 Па. Скільки молекул газу залишається при такому вакуумі в камері ємкістю 5х10-5 м3 при температурі 270С?
Лекція №6
Тема: Основи молекуляірно - кінетичної теорії.
Мета: Ознайомити студентів з різними видами пароутворення та їх власти-
востями. Ввести поняття насичення та ненасичення пара. Ознайомити з поняттям вологість повітря і приладами для їх вимірювання.
Оснащення: Таблиці, опорні конспекти, психрометр, гігрометр.
План лекції.
1. Випаровування і конденсація. Залежність випаровування від різних параметрів.
2. Насичена і ненасичена пара, їх властивості.
3. Кипіння. Залежність температури кипіння від тиску.
4. Вологість повітря та її вимірювання. Точка роси.
Література.
1. Гончаренко С. У. Фізика: Пробн. навч. посібник для ліцеїв та класів природничо – наукового профілю. 10 кл. К. “Освіта”, 1995, с. 56…64, с. 76…81.
2. Л.С. Жданов, Г. Л. Жданов “Фізика для середніх спеціальних навчальних закладів” К., Вища школа, 1983, с. 71…82, с. 86…89.
Зміст лекції.
1). У природі, в техніці і побуті ми часто спостерігаємо перетворення рідких і твердих тіл у газоподібний стан (висихають камохи, белізна, зникають шматки сухого льоду, зменшуються розміри шматочків нафталіну і т.д.). Спостерігається процес перетворення речовин у газоподібний стан — у пару.
Пароутворення відбувається двома способами — випаровування і кипіння.
Випаровування — це пароутворення лише з поверхні рідини.
Цей процес відбувається будь-якої температури. Найбільш швидкі молекули можуть відірватися від поверхні і вийти із сфери дії молекулярних сил. Тому над рідиною завжди є її вільні молекули, які утворюють пару.
Оскільки відриваються і покидають рідину найбільш швидкі молекули, середня кінетична енергія молекул, які залишилися, зменшуються. Внаслідок цього, рідина під час випаровування охолоджується. Щоб температура рідини залишилася сталою слід безперервно підводити до неї енергію, що дорівнює роботі, виконуваній проти сил зчеплення молекул і проти сили зовнішнього тиску під час перетворення рідини в пару.
Внаслідок хаотичного руху, молекули пари можуть повертатися в рідину. Цей процес називають конденсацією пари. При наближенні до рідини сили притягання прискорюють рух молекули, надаючи їй додаткової кінетичної енергії і, повернувшись, вона має таку саму кінетичну енергію, яку мала під час випаровування. Тому під час конденсації пари виділяються стільки ж енергії, скільки було затрачено на її утворення швидкість вимірювання тим більша, чим вища температура рідини, чим більша її поверхня, чим швидше віддаляється пара, яка утворилася над нею, чим менше тиск на неї, а також від речовини, яка випаровується.
2) Інша картина спостерігається, якщо рідина міститься в закритій посудині і займає лише частину її об’єму. Чим більше молекул вилетіло з рідини, тим більша їх кількість повертається назад в рідину. Настає момент коли кількість вилітаючих з рідини в одиницю часу молекул дорівнює кількості молекул, що повертаються в неї за той же час. З цього моменту концентрація молекул пару буде сталою. Такий стан називають динамічною рівновагою пари і рідини.
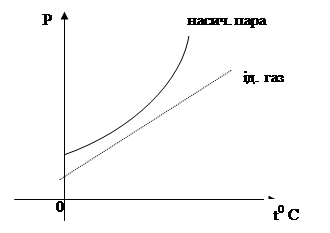
Рідину в динамічній рівновазі із своєю парою називають насиченою. Насичена пара має при даній температурі максимальну густину і чинить найбільший тиск.
Пара, яка не в динамічній рівновазі із своєю рідиною називається ненасиченою. Тобто ненасиченою буде пара над поверхню рідини, якщо випаровування переважає над конденсацією. Густина ненасиченої пари менша за густину насиченої пари.
Властивості ненасиченої пари можна описувати газовими законами для ідеального газу. Але для насиченої пари їх застосовувати не можна. Тиск ненасиченої пари при незмінній температурі величина стала. Він не залежить від її об’єму. Причина посягає в тому, що концентрація її молекул у закритому об’єму з рідиною завжди одна й та сама незалежно від об’єму, який займає пара. Тиск насиченої пари зростає з підвищенням температури, але ця залежність не виражається законом Шарля. Це відбувається тому, що під час нагрівання насиченої пари збільшується не лише енергія його молекул, а й кількість цих молекул. Тому тиск насиченої пари зростає різкіше, ніж для ідеального газу.
Але для насиченої пари можна застосувати рівняння Клапейрона і рівняння м. п. Т
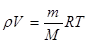
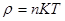
3) Можливий і другий вид пароутворення — кипіння. Кипіння відбувається тільки при повній температурі і супроводжується утворенням по всьому об’єму рідини пухирців пари, які швидко зростають і спливають на поверхню.
Кипіння — це випарювання всередині рідини з виділенням пухирців пари. Кипіння відбувається при температурі, коли тиск насиченої пари рідини стає рівним атмосферному (або трохи перевищує його).
При зменшенні тиску на рідину температура її кипіння має знижуватися, а при збільшенні — підвищуватися.
Зі зниженнями температури тиск пари над водою в колбі зменшується, і рідина закипає знову при порівняно низький температурі.
Кипіння води під зниженим тиском має застосування в цукровій промисловості. Кристалізацію цукру проводять у котлах із зниженим тиском, завдяки чому цукровий сироп бурхливо кипить при температурі всього в кілька десятків градусів. При цьому не виникає небезпека пригорання цукру і швидко вилучається зайва вода.
Коли треба підвищити температуру води комод 1000С, створюють великий тиск над ії поверхню. Такі пристрої називають автоклави. Їх використовують у хімічній та харчовій промисловостях, в медицині для стерилізації хірургічних інструментів, для обробки деревини на паперових фабриках. Кипіння під підвищеним тиском використовується для одержання синтетичної могоржи, гліцерину, жирних кислот.
Властивість рідини закипати під тиском при вищої температурі зробило можливими застосовування потержених парових двигунів високого тиску. У парових турбінах потужністю 200 тис. кВт використовується пара під тиском 2·107 Па і t = 6000 С. Це забезпечує значну економію пального і високий ККД турбін.
Для підтримання кипіння необхідно підводити до рідини енергію ззовні. Чим більше рідини треба випарювати, тим більшу кількість теплоти слід підвести до неї.
Здатність різних речовин до випарювання характеризується питомою теплотою пароутворення r — кількістю теплоти необхідно для перетворення одиниці маси рідини в пару при температурі кипіння.
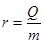
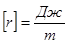
Ця величина залежить від сил молекулярного притягання. Під час кипіння температура рідини дорівнює температурі пари і залишається сталою величиною. Енергія, яка підводиться, затрачується на подолання сил зчеплення молекул рідини і відривання їх від неї, внаслідок чого середня потенціальна енергія молекул пари більша ніж молекул рідини. Тому під час конденсації пари виділяється кількість теплоти, яку називають теплота конденсації і яка дорівнює теплоті пароутворення. В цьому проявляється закон збереження енергії при зміні агрегатного стану речовини.
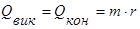
4) В атмосфері Землі завжди міститься величезна кількість водяної пари. Наявність водяної пари є необхідною умовою існування життя на Землі. Протягом року випаровується близько 4,25·1014 т води і близько ¼ цієї води випадає у вигляді опадів. Ступінь вологості впливає на розвиток флори і фауни, на врожай сільськогосподарських культур, на продуктивність тваринництва. Значну роль відіграє вологість у процесах сушіння виробів, зберігання готових виробів.
Величина, яка характеризує вміст водяної пари в атмосфері, називається вологістю.
Для кількісної оцінки вологості повітря використовують абсолютну і відносну вологість повітря.
Абсолютна вологість повітря вимірюють густиною водяної пари rа, яка є в повітрі, або її тиском ра.
Отже ця величина показує, яка маса пари води міститься в 1 м3 повітря (rа).
Тиск можна вимірювати за рівнянням Менделєєва:

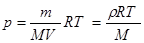
Абсолютна вологість не визначає, наскільки повітря сухе чи вологе, оскільки це залежить і від температури повітря. Якщо температура низька, то для даної кількості водяної пари в повітрі вона може бути близька до насичення і повітря буде сирим. Для високих температур та сама водяна пара далека від насичення і повітря сухе.
Ступінь вологості характеризується відносною вологістю. Вона вимірюється відношенням абсолютної вологості до кількості пари, необхідної для насичення 1м3 повітря при тій самій температурі.
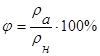
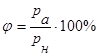
Отже, відносна вологість визначається не тільки абсолютною вологістю, а й температурою повітря. Під час обчислень відносної вологості значення rн і рн беруться з таблиць.
Температура, при якій повітря в процесі свого охолодження насичується водяною парою називається точкою роси. Прилади для визначення вологості повітря називають гігрометрами (від грецького “гігрос”—вологий). Абсолютну вологість повітря можна визначити, вимірявши температуру, яка відповідає точці роси. Для цього користуються конденсаційним гігрометром.
Для швидкого визначення вологості користуються психрометром. Він складається з 2-ох термометрів (сухого і вологого). За різницею показів сухого і вологого термометра визначають відносну вологість за психометричною таблицею. Чим сухіше повітря, тим більша різниця показів сухого і мокрого термометрів. Якщо повітря насичене водяною парою, то покази термометрів однакові і відносна вологість становитиме 100%, що можливо під час дощу, або туману.
Питання для самоконтролю
1. Що таке пароутворення?
2. Які способи пароутворення ви знаєте?
3. Що таке випаровування?
4. Що таке конденсація?
5. Чому під час випаровування знижується температура рідини?
6. Від чого залежить швидкість випаровування?
7. Яка пара називається насиченою? Чи застосовані до неї закони ідеального газу?
8. Яка пара називається ненасиченою?
9. Що відбувається з насиченою парою при ізотермічному зменшені (збільшені) її об’єму?
10. Чим відрізняється кипіння рідини від її випаровування?
11. За якої умови починається кипіння рідини?
12. Як залежить температура кипіння рідини від зовнішнього тиску?
13. Як визначається питома теплота пароутворення?
14. Що таке абсолютна і відносна вологість?
15. Що таке точка роси? Як пояснити утворення туману?
16. Якими приладами визначається вологість повітря?
Лекція №7.
Тема 1: Основи молекулярно - кінетичної теорії».
Мета: Ознайомити студентів з властивостями рідкого стану, з поняттям молекулярний тиск, поверхневий шар, поверхневий натяг, енергія поверхневого шару, змочування, капілярність.
Оснащення: таблиці, опорні конспекти, капілярні трубки, розчин мильної води, каркаси металеві різної форми.
План лекції.
1. Рідини, їх основні властивості. Молекулярний тиск.
2. Поверхневий натяг. Енергія поверхневого шару рідини.
3. Явища на межі рідини з твердим тілом. Капілярні явища.
Література.
1. С.У. Гончаренко “Фізика” –10 кл. К. ”Освіта” 1995, с. 82…92.
2. Л.С. Жданов, Г.Л. Жданов “Фізика для середніх спеціальних навчальних закладів” К. ”Вища школа” 1985 с. 89…98.
3. В.Л. Прокоф’єв, В.Ф. Дмитрієва “Фізика - посібник для учнів технікуму” К. ”Вища школа” 1985” с. 48…52.
Зміст лекції.
1) Рідина це агрегатний стан речовини, проміжний між газоподібним і твердим. Рідина зберігає свій об’єм, але набуває форми посудини, в яку її налито. відповідь на питання до чого ближче властивості рідини: до газу чи твердого тіла, — залежить від того, при яких температурах і тисках її порівнюють. Це можна пояснити з точки зору М.К. Т..
Збереження об’єму рідини доводить, що між її молекулами діють сили притягання. Отже, відстані між молекулами рідини менші за радіус молекулярної дії. Молекулярні сили діють на коротких відстанях –10-9м.
 |
мал. 1.
Якщо описати навколо молекули М сферу радіусом дії молекулярних сил, то молекули М1, М2, М3 притягуватимуться до нашої молекули, а М4, М5 — ні, оскільки міститься на відстанях, більших за радіус молекулярної дії (малюнок 1—зліва). Всередині сфери частинки розподілені рівномірно, внаслідок цього результуюча молекулярних сил, прикладених до молекули М дорівнює нулю. Тому сили притягання не заважають молекулам переміщатися одна відносно одної всередині рідини. Ці сили взаємодії утримують молекулу рідини біля її тимчасового положення рівноваги протягом 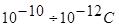 , після чого вона переказує в нове тимчасове положення рівноваги приблизно на відстань свого діаметра. Час між двома перескоками молекули називається часом осілого життя. Цей час залежить від рідини і її температури. Протягом цього часу більшість молекул перебуває в своїх положеннях рівноваги, подібне до їх розміщення в кристалічній решітці твердого тіла. Потім це упорядковане розміщення молекул розпадається, але виникає в іншому місці. Отже, у невеликому об’ємі рідини спостерігається упорядковане розміщення її молекул, а у великому об’ємі воно хаотичне. Тому кажуть, що в рідині існує ближній порядок у розміщенні молекул і не має далекого порядку. Таку будову рідини називають квазікристалічною (кристалоподібною). За час довший за часом осілого життя більшість молекул рідини встигне змінити своє місцеположення. Тому рідина має текучість і набуває форми посудини, в якій вона міститься.
, після чого вона переказує в нове тимчасове положення рівноваги приблизно на відстань свого діаметра. Час між двома перескоками молекули називається часом осілого життя. Цей час залежить від рідини і її температури. Протягом цього часу більшість молекул перебуває в своїх положеннях рівноваги, подібне до їх розміщення в кристалічній решітці твердого тіла. Потім це упорядковане розміщення молекул розпадається, але виникає в іншому місці. Отже, у невеликому об’ємі рідини спостерігається упорядковане розміщення її молекул, а у великому об’ємі воно хаотичне. Тому кажуть, що в рідині існує ближній порядок у розміщенні молекул і не має далекого порядку. Таку будову рідини називають квазікристалічною (кристалоподібною). За час довший за часом осілого життя більшість молекул рідини встигне змінити своє місцеположення. Тому рідина має текучість і набуває форми посудини, в якій вона міститься.
Якщо час дії сили на рідину малий, то рідина проявляє пружні властивості. При різкому ударі палицею об поверхню рідини, вона може вилетіти із руки або зламатися. струмина рідини, яка виривається під великим тиском з вузького отвору, може різати сталь, граніт та інші матеріали. Так за допомогою гідромоніторів добувають вугілля у відкритих кар’єрах. Людина вільно входить у воду з берега річки, але якщо стрибне з вишки і вдариться об поверхню води, то сильно заб’ється, оскільки в цьому випадку рідина поводиться як тверде тіло. Камінь можна кинути так, що він при ударі о поверхню води вискакує в неї і здійснює кілька стрибків. Це означає, що властивості рідкого стану речовини ближчі до властивостей твердого стану, ніж до властивостей газоподібного.
Сили молекулярної взаємодії в рідині відіграють основну роль. Молекулярний тиск в них дуже великий. Для води близько 1100 МПа. Але треба розуміти, що це не тиск як прийнято в газових законах, а умовне позначення величини, яка враховує дію молекулярних сил.
Великим значенням молекулярного тиску пояснюється, що рідина практично не стислива. він не діє на стінки посудини і на занурені в неї тіла.
2) В іншому положенні перебувають молекули на поверхні рідини (мал.1. справа). Товщина поверхневого шару дорівнює радіусу молекулярної взаємодії. Внаслідок неоднорідності оточення на молекулу діє сила 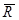 , не скомпенсована силами з боку інших молекул рідини. На таку молекулу діють сили, складові яких у вертикальних та горизонтальних площинах різна. Сили у вертикальній площині прагнуть втягти молекулу в середину рідини. Зазнаючі однобічної дії, напрямленої в середину рідини, молекули поверхневого шару стискають рідину, чинять на неї тиск.
, не скомпенсована силами з боку інших молекул рідини. На таку молекулу діють сили, складові яких у вертикальних та горизонтальних площинах різна. Сили у вертикальній площині прагнуть втягти молекулу в середину рідини. Зазнаючі однобічної дії, напрямленої в середину рідини, молекули поверхневого шару стискають рідину, чинять на неї тиск.
Сили, які діють у горизонтальній площині, ніби стягують поверхню рідини, їх називають силами поверхневого натягу. Ця сила спрямована перпендикулярно до будь-якого елемента лінії, проведеній на поверхневій плівці, вздовж дотичної до поверхні рідини. Відомо, що з усіх можливих тіл, які мають однаковий об’єм найменшу поверхню має куля. Якщо в розчин спирту у воді влити прованської олії (густини їх однакові), то, перебуваючи в байдужій рівновазі, олія набирає форму кулі.
Для кількісної оцінки сили поверхневого натягу її відносять до одиниці довжини межі поверхневого шару. Цю величину називають поверхневим натягом:
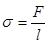 ,
, 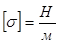
s — величина стала і не залежить від l.
При підвищенні температури рідини збільшується середня відстань між її частинками, а сили молекулярного притягання зменшуються і поверхневий натяг зменшується в кристалічній точці, коли густина рідини і пари одинакові, поверхневий натяг дорівнює нулю.
Поверхневий натяг залежить від домішок до рідини. Речовини, які послабляють поверхневий натяг рідини, називаються поверхнево – активними. відносно води це мило, ефіри, спирти, нафта.
Оскільки молекули рідини, розміщенні в її поверхневому шарі, втягуються всередину рідини, їх потенціальна енергія більша, ніж у молекул всередині рідини. Цю додаткову потенціальну енергію молекул поверхневого шару рідини називають вільною енергією. Щоб вивести молекулу з середини рідини на її поверхню, треба подолати протидію молекулярних сил, тобто виконати роботу, яка є мірою вільної енергії поверхні: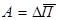 Зміна вільної енергії пропорційна зміні площі вільної поверхні рідини. Отже,
Зміна вільної енергії пропорційна зміні площі вільної поверхні рідини. Отже, 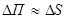 , тому
, тому
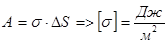 ;
;
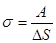
Тобто коефіцієнт поверхневого натягу дорівнює відношенню роботи, яку треба виконати при сталій температурі, щоб утворити поверхню рідини площею DS, до площі цієї поверхні. Вільна енергія поверхні рідини може переходити в інші форми енергії, або може виконуватися робота по переміщенню рідини.
3) Якщо рідина стискається з поверхнею твердого тіла, можливі два випадки: рідина змочує тверде тіло і і рідина не змочує твердого тіла (ртуть зберігається в окремій краплі, якщо її помістить на скло. зате на цинку. міді чи залізі ртуть розпливається тонким шаром).
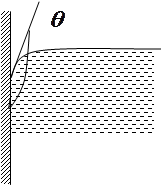
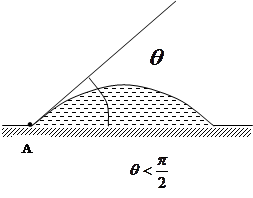 Змочування рідиною твердого тіла пояснюється тим. що зчеплення між молекулами рідини і твердого тіла сильніше за притягання між частинками рідини. Коли рідина не змочує твердого тіла, взаємне притягання її молекул між собою більше, ніж притягання її до молекул твердого тіла. Мірою змочування являється крайовий кут. він утворюється плоскою поверхнею твердого тіла і площиною, дотичної до вільної поверхні рідини, що проходить через точку А, де межують тверде тіло, рідина і газ. Всередині крайового кута завжди є рідина.
Змочування рідиною твердого тіла пояснюється тим. що зчеплення між молекулами рідини і твердого тіла сильніше за притягання між частинками рідини. Коли рідина не змочує твердого тіла, взаємне притягання її молекул між собою більше, ніж притягання її до молекул твердого тіла. Мірою змочування являється крайовий кут. він утворюється плоскою поверхнею твердого тіла і площиною, дотичної до вільної поверхні рідини, що проходить через точку А, де межують тверде тіло, рідина і газ. Всередині крайового кута завжди є рідина.
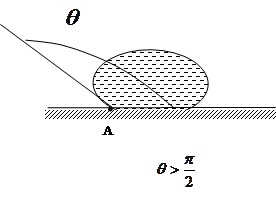 |
Для рідини. яка змочує поверхню твердого тіла, крайовий кут гострий (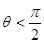 ). Чим краще змочування, тим менше кут. Для повного змочування
). Чим краще змочування, тим менше кут. Для повного змочування  . Для незмочуючих рідин крайовий кут
. Для незмочуючих рідин крайовий кут  . При повному незмочуванні
. При повному незмочуванні  .
.
Змочування чи незмочування рідиною стінок посудини, в яку вона налита. впливає на форму її вільної поверхні.
Змочуюча стінки рідина біля країв посудини піднімається, а незмочуюча—спускається.
 | |||
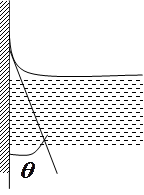 | |||
Особливо чітко це видно у вузьких трубках. Викривлену поверхню рідини у вузьких циліндричних трубках називають меніском у змочуючої рідини утворюється угнутий меніск, а внезмочуючої — опуклий.
 |
Оскільки площа поверхні меніска більша, ніж площа внутрішнього перерізу трубки, то, внаслідок дії молекулярних сил, викривлена поверхня рідини прагне випрямитись і цим створює додатковий тиск —рл, який при змочуванні напрямлений від рідини, а при незмочуванні — всередину рідини. Величину цього тиску визначив французький вчений Лаплас, тому його називають лапласовським тиском. Для сферичної форми вільної поверхні рідини з радіусом R цей тиск визначається формулою:
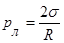
Особливо добре спостерігається викривлення меніска рідини в вузеньких трубках, які називаються капілярними. Викривлення поверхні рідини у капілярах приводить до порушення закону сполучених посудин.
 | |||
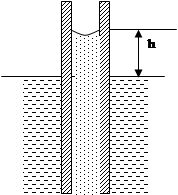 | |||
Явища, зумовлені втягуванням змочуваючих рідин у капіляри, або виштовхування незмочуючих рідин з капілярів, називаються капілярними явищами.
Лапласівський тиск втягує воду вгору доти, поки не буде зрівноважений гідростатичним тиском:
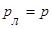 ,
,
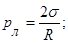
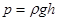
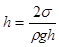
 При повному змочуванні (
При повному змочуванні (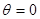 ) меніск має форму півсфери і радіус сферичної поверхні R дорівнює внутрішньому радіусу трубки r. Тоді:
) меніск має форму півсфери і радіус сферичної поверхні R дорівнює внутрішньому радіусу трубки r. Тоді: 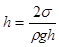 .
.
При неповному змочуванні (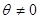 ) радіус меніска
) радіус меніска 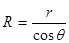 , тому
, тому 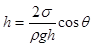 .
.
Висота підняття рідини в капілярній таблиці прямо пропорційна поверхневому натягу і обернено пропорційна радіусу трубки і густині рідини. Капілярні явища можна спостерігати не тільки в трубках, але й у вузьких щілинах.
Капілярність надзвичайно поширена в природі, техніці і побуті і відіграє велику роль у різноманітних процесах.
У поселинах волога з грунту піднімається по капілярах до вершини, де через листя випаровується. Є капіляри і в грунті. Капілярами грунту волога піднімається і швидко випаровується, а земля стає сухою. Для збереження вологи капіляри слід зруйнувати.
У будівельні практиці доводиться врахувати можливість підняття вологи капілярними порами будівельних матеріалів. Для захисту фундаменту і стін від грунтових вод і вологості вдаються до гідроізоляції, змащують кладки бітуном, зашивають гідрофобним цементом, прокладають шар толю, смоли, або іншими речовинами, що перешкоджає прониканню вологи. В паперовій промисловості треба врахувати капілярність. Писальний папір просочують спеціальною сполукою, яка закупорює капіляри. Застосування рушників, серветок. гігроскопічної вати, марлі, промокального паперу, у перах для подавання чорнил та інше. все це можливо лише наявності капілярів.
Питання для самоконтролю.
1. Як ви розумієте твердження про ближній порядок у розміщенні частинок рідини?
2. Які сили створюють поверхневий натяг? від чого він залежить?
3. Молекулярний тиск, його властивості.
4. Поверхневий натяг. Одиниці виміру.
5. Поверхневий шар рідини, його властивості.
6. Вільна енергія, її визначення.
7. Як пояснити змочування рідиною твердого тіла?
8. Як впливає форма поверхні рідини на внутрішній (молекулярний) тиск?
9. Лапласовський тиск, його напрям і визначення.
10. Що таке капілярність? Чому змочуюча рідина піднімається в капілярах, а незмочуюча опускається?
11. Застосування капілярності.
Лекція №8
Тема 1 ”Основи молекулярно – кінетичної теорії.”
Мета: Ознайомити студентів з поняттям монокристал, полікристал, аморфні тіла, рідкі кристали, анізотропія. Ознайомити з різними видами кристалічних структур. Ознайомити студентів з різними видами деформації, кількісними її характеристиками і механічними властивостями твердих тіл.
Оснащення: Таблиці, опоні конспекти, прилади для демонстрації деформації.
План лекції.
1. Кристалічні тверді тіла. Анізотропія кристалів.
2. Види кристалічних структур.
3. Деформація твердих тіл. Механічні властивості твердих тіл
4. Аморфні речовини і їх властивості. Рідкі кристали.
Література.
1. Гончаренко С. У. Фізика: Пробн. навч. посібник для ліцеїв та класів природничо – наукового профілю. 10 кл. К. “Освіта”, 1995, с.93…99, с.114…122, с.126…130.
2. Л.С. Жданов, Г. Л. Жданов “Фізика для середніх спеціальних навчальних закладів” К., Вища школа, 1983, с. 71…82, с. 86…89.
3. В.Л. Прокоф’єф, В.Ф. Дмітрієва “Фізика – посібник для учнів технікуму” К. “Вища школа,” с.56…60.
Зміст лекції.
1) Якщо речовина зберігає свою форму об’єм її називають твердою. Різні тверді тіла в природі можна поділити на дві групи, які відрізняються за своїми властивостями. Першу групу утворюють кристалічні тіла, а другу — аморфні.
Вивчення внутрішньої будови кристалів дало змогу встановити, що частинки в кристалах утворюють кристалічну (просторову) решітку. Точки в кристалічній решітці, які відповідають положенню рівноваги частинки, яка входить до складу кристала, називають вузлами решітки. Вузли мають правильне розміщення, яке періодично повторюється всередині кристала вздовж будь-якої прямої. Правильне розміщення частинок в вузлах решітки називають далеким порядком у розміщенні частинок.
У фізиці під твердими тілами розуміють лише такі речовини, які мають кристалічну будову. У твердого тіла обов’язково повинен бути далекий порядок у розміщенні його частинок. Було встановлено, що багато твердих тіл у природі мають гладенькі плоскі поверхні, розміщенні під певними кутами. Для кристалів кожної речовини характерною є сталість кутів між її ребрами і між її гранями. Такі тіла називають монокристалами (шматочки цукру, солі, гірського кристалу). Їх відмітною рисою є анізотропія. Це залежність ряду фізичних властивостей, таких, як швидкість поширення світла, коефіцієнт теплопровідності, модуль пружності, електропровідність тощо, від напрямку. Наприклад, смода легко розщеплюється на пластинки, кам’яна сіль колеться на кубики.
Кристалічне тіло, яке є множиною безладно орієнтованих монокристалів, називаються полікристалами. Полікристалічні тіла ізотропні, тобто їх фізичні властивості у всіх напрямках однакові.
Майже всі напівпровідникові прилади є кристалами із спеціально введеними долітками. Останнім часом виникла нова галузь електроніки — молекулярна електроніка, яка гру6нтується на створенні в монокристалі під час його впрошування ділянок з різними властивостями.
2) У фізиці кристалічні структури розглядають не з точки зору їх геометрії, а за характером сил, які діють між частинками кристала. Залежно від характеру сил взаємодії і природи частинок, розміщених у вузлах кристалічної решітки, розрізняють чотири типа кристалічних решіток.
1) Атомні кристали. У вузлах решітки нейтральні атоми між якими є ковалентний зв’язок. Це такий зв’язок при якому два сусідні атоми вдержуються поряд силами притягання, що виникають при взаємному обміні двома валентними електронами між цими атомами. Ковалентний зв’язок створює дуже міцні кристали. Такі речовини мають велику механічну міцність і плавляться превеликих температурах (алмаз, германій, кремній).
2) Іонні кристали. У вузлах кристалічної решітки розміщенні іони різних знаків. Зв’язок між ними зумовлений електричними (кулонівськими) силами взаємодії (кам’яна сіль, хлористий цезій CsCl, польовий сикат CaF2, AuZn, MgAg, CfAg). Іонні кристали слабо розширюються при нагріванні і мають високу температуру плавлення. При плавленні в розплав переходять іони, які стають рухомими носіями заряду. Тому такі розплави є добрими провідниками електричного струму.
3) Молекулярні кристали. У вузлах кристалічної решітки розміщуються певним способом орієнтовані молекули, зв’язок між якими забезпечується силами молекулярної взаємодії. Ці сили слабкі тому молекулярні кристали менш міцні і плавляться при дуже низькій температурі (твердий галій, водень, кисень, азот, сухий лід СО2, нафталін, парафін, кристали брому, йоду).
4) Металеві кристали. У вузлах кристалічної решітки розміщенні позитивні іони металу, між якими рухаються вільні (валентні) електрони, що утворюють електронний газ. Електрони і додатні іони взаємно зв’язують одні одних; електрони не можуть покинути метал завдяки притяганню до додатно заряджених атомів металу, а кристалічна решітка не “розсипається” завдяки “цементуючій” дії електронного газу. Існування електронного газу в металах пояснюються як висока теплопровідність, так і висока електропровідність усіх металів.
3) Під дією зовнішніх сил, при нагріванні або охолодженні змінюється об’єм тіла, що супроводиться зміною його форми — тіло деформується. Деформації, які зовсім зникають після припинення дії деформуючих факторів, називають пружними. Деформації, які не зникають після припинення дії деформуючих факторів, називають пластичними. Збільшення довжини тіла під дією сил, які розтягують його в одному напрямі, називають деформацією поздовжнього розтягу.
|
|




Зменшення довжини тіла під дією сил, які стискають його в одному напрямі, називаються деформацією поздовжнього стиску.
|
|




Збільшення об’єму тіла під дією сил, які розтягують його в усіх напрямках, називається деформацією всестороннього розтягу. Зменшення об’єму тіла під дією сил, які стискають його в усіх напрямках, називається деформацією всестороннього стиску. Згин стержня під дією сил, перпендикулярних до його осі. називається деформацією поперечного згину.

|
Згин стержня при повздовжньому стиску, називається деформацією повздовжнього згину.
 |
Ще можна спостерігати деформацію зсуву та кручення.
Величину будь-якої деформації можна оцінити абсолютною деформацією — це числова зміна якого-небудь розміру тіла під дією сил. при односторонньому розтягу (списку) абсолютною деформацією є зміна довжини тіла Dl, при всесторонньому розтягу (стиску) зміни об’єму — DV.
Проте накомітною оцінкою зміни форми є відносна деформація — e.
Відносною деформацією називають число, що показує, яку частину від початкового розміру тіла l становить абсолютна деформація —Dl
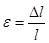 — це при односторонньому розтягу (стиску).
— це при односторонньому розтягу (стиску).
У процесі деформації твердого тіла частинки, розміщенні у вузлах кристалічної решітки, зміщуються одна відносно одної. Цьому зміщенню перешкоджають внутрішні пружні сили, що діють між частинками твердого тіла. Вони спричиняють деформацію кожного елемента тіла.
Величина, яка характеризує дію внутрішніх сил у деформованому твердому тілі, називається механічною напругою:
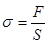 ,
, 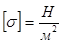
Отже, механічна напруга вимірюється внутрішньо. силою, яка діє на одиницю площі перерізу деформованого тіла. Якщо сила діє перпендикулярно до перерізу, напруга називається нормальною —sn. Якщо сила діє паралельно перерізу, напругу називають дотичною — sд.
Гук ще в XVII ст. встановив, що в межах пружних деформацій нормальна напруга і відносне видовження зв’язані співвідношенням:
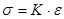 —закон Гука
—закон Гука
К— модуль пружності. Він характеризує залежність механічної напруги в матеріалі від роду останнього і від зовнішніх умов.
Модуль пружності вимірюється механічною напругою, яка виникає в матеріалі при відносній пружній деформації, що дорівнює одиниці (К=s, якщо e=1).
Для деформації одностороннього розтягу (стиску):
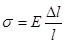 ,
,
де Е— модуль пружності для цього виду деформації. Його називають Модулем Юна.
Він вимірюється нормальною напругою, яка виникає в матеріалі при збільшені довжини зразка в два рази (Dl=l). Значення модуля Юна беруться з таблиць.
Оскільки 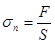 , то
, то 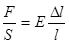 ,
, 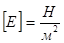 , звідки
, звідки 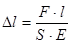
Отже, абсолютна деформація під час поздовжнього розтягу або стиску прямо пропорційна силі, яка діє на тіло та довжині тіла, обернена пропорційна площі поперечного перерізу і залежить від роду речовини.
Найбільша напруга в матеріалі, після зникання якої форма і об’єм тіла відновлюється, називається границею пружності —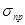 . Після досягнення границі пружності в тілі виникають пластичні деформації. Напругу, при якій починає розвиватися пластична деформація, називається границею текучості.
. Після досягнення границі пружності в тілі виникають пластичні деформації. Напругу, при якій починає розвиватися пластична деформація, називається границею текучості.
Найбільше навантаження, яке витримує зразок перед розриванням, називають навантаженням границі міцності, а напругу —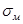 —яка відповідає цьому максимальному навантаженню — границею міцності. Міцність — це одне з найважливіших механічних характеристик матеріалу. Під міцністю розуміють здатність матеріалу опиратися руйнуванню і залишковій деформації, які виникають внаслідок зовнішніх впливів.
—яка відповідає цьому максимальному навантаженню — границею міцності. Міцність — це одне з найважливіших механічних характеристик матеріалу. Під міцністю розуміють здатність матеріалу опиратися руйнуванню і залишковій деформації, які виникають внаслідок зовнішніх впливів.
Будуючи машини і споруди, завжди створюють запасміцності або коефіцієнт безпеки. Це величина, яка показує, у скільки разів границя міцності перевищує допустиму напругу. Цей коефіцієнт лежить в межах 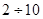 . Особливо великим має бути запас міцностей у деталей, які зазнають різного роду ударів: у гвинтів літаків, циліндрів і поршнів двигунів внутрішнього згорання, стволів артилерійських гармат.
. Особливо великим має бути запас міцностей у деталей, які зазнають різного роду ударів: у гвинтів літаків, циліндрів і поршнів двигунів внутрішнього згорання, стволів артилерійських гармат.
У деяких тіл 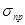 дуже мало відрізняється від
дуже мало відрізняється від 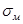 , тобто в них практично відсутня пластична деформація і пружна деформація завершується руйнуванням. Такі речовини називають крихкими (чавун, загартована сталь). Властивість руйнуватися до виникнення помітних пластичних деформацій — крихкість — доводиться врахувати, вибираючи матеріали для виготовлення деталей машин і споруд.
, тобто в них практично відсутня пластична деформація і пружна деформація завершується руйнуванням. Такі речовини називають крихкими (чавун, загартована сталь). Властивість руйнуватися до виникнення помітних пластичних деформацій — крихкість — доводиться врахувати, вибираючи матеріали для виготовлення деталей машин і споруд.
4) Ми вже згадували, що поряд з кристалами існують тіла, які в побуті вважають твердими, хоча вони не мають кристалічної будови. Ці тіла складаються з аморфних речовин. До них належать приладні сполуки: смоли, буритин, опал —і штучні: скло, плавлений кварц.
Аморфні тіла ізотропні. Вони не мають певної температури плавлення. Ще однією характерною особливістю є пластичність, тобто відсутність границі пружності. Відрізняються вони від рідини лише ступенем в’язкості. Залежно від характеру впливу (часу, за який діє сила) аморфні речовини поводяться то як крихкі тверді тіла, то як дуже в’язкі рідини.
Для аморфних тіл, як і для рідин, характерний механічний порядок у розміщенні частинок. Відрізняються вони від рідин меншими середніми відстанями між молекулами і в зв’язку з цим більшими силами молекулярного притягання. Тому аморфні тіла можна вважати переохолодженими рідинами.
Аморфний стан нестійкий: через неповний час аморфна речовина переходить у кристалічну. Але часто цей час вимірюється роками і десятиріччями.
Крім аморфного, відкрито ще один стан речовини з подвійною природою— і рідини, й твердого тіла—це рідки кристали. У деяких випадках у речовин в рідкому стані може спостерігатися і дальній порядок розміщення частинок. такі речовини, що поєднують властивість рідин і кристалів, називаються рідкими кристалами. Вони текучі і утворюють краплі, які мають видовжену форму. В рідких кристалах впорядкована орієнтація молекул в одному з напрямків, тому вони анізотропні. За механічними властивостями вони нагадують рідини, в’язкість яких коливається від рідкого клею до твердого скла. Існують рідки кристали в певному інтервалі температур. При нагріванні вони перетворюються у рідину, при охолодженні стають твердими кристалами.
Зараз відомо понад 3000 речовин, які утворюють рідки кристали. Властивість рідких кристалів різко змінюється при незначній зміні зовнішніх умов (температур, електричного і магнітного полів).
На основі рідких кристалів опрацьовано перетворювач інфрачервоного зображення у видиме, прилади для вимірювання коливань температури. Надзвичайно велике значення рідких кристалів у біології і медицині.
Питання для самоконтролю
1. Які тіла у фізиці називають твердими?
2. Що таке монокристал?
3. Як ви розумієте поняття “анізотропія”?
4. Які речовини називають полікристалічними і чому вони ізотропні?
5. Що таке вузол кристалічної решітки?
6. Які існують типи кристалічних решіток. Які частинки розміщенні в вузлах кристалічної решітки і які сили їх утримують?
7. Що таке деформація. Назвіть види деформації?
8. Як можна оцінити величину деформації?
9. Що таке механічна напруга, нормальна напруга і дотична напруга?
10. Сформулюйте закон Гука для пружної деформації?
11. Модуль Юнга, його фізичний зміст та одиниці виміру?
12. Що таке границя пружності, границя міцності?
13. Які тіла називають крихкими?
14. Що таке коефіцієнт безпеки?
15. Аморфні тіла та їх властивості.
16. Рідкі кристали, їх властивості і застосування.
Лекція №9
Тема: “Рівняння теплового балансу для найпростіших теплових процесів при теплообміні і спалюванні палива.”
Мета: дати означення внутрішньої енергії тіла і ознайомити зі способами зміні внутрішньої енергії. Розібрати приклади застосування рівняння теплового балансу. Види палива, визначення к.к.д. нагрівника.
Оснащення: опорні конспекти, таблиці, калориметр.
План лекції
1. Внутрішня енергія тіла і способи її зміни.
2. Зміна внутрішньої енергії тіл в процесі нагрівання і охолодження. Рівняння теплового балансу при теплообміні.
3. Рівняння теплового балансу при пароутворенні і конденсації.
4. Рівняння теплового балансу в процесі плавлення і тверднення.
5. Зміна внутрішньої енергії під час згорання палива. Коефіцієнт корисної дії нагрівника.
Література
1. Гончаренко С. У. Фізика: Пробн. навч. посібник для ліцеїв та класів природничо– наукового профілю. 10 кл. К. “Освіта”, 1995, с. 137…142.
2. Л.С. Жданов, Г. Л. Жданов “Фізика для середніх спеціальних навчальних закладів” К., Вища школа, 1983, с. 60…63, с. 78…82, с.113…115.
Зміст лекції
1). Тіло складається з молекул, які перебувають у безперервному і хаотичному русі. Кожна молекула має певну кінетичну енергію. Крім того, між частинками діють сили притягання і відштовхування. Отже, молекули мають і потенціальну енергію.
Суму кінетичної і потенціальної енергії всіх молекул тіла називають його внутрішньою енергією.— U.
Внутрішня енергія системи залежить тільки від її стану і є однозначною функцією стану.
Внутрішня енергія залежить від характеру взаємодії всіх частинок, тому треба врахувати енергію електронів, атомів, іонів, внутрішньоядерну енергію, енергію, яка пов’язана з обертальним і коливальним рухами молекул. Але в молекулярній фізиці розглядаються тільки такі явища, при яких молекули не змінюються, тому можна вважати, що зміна внутрішньої енергії тіла зв’язана лише зі зміною молекулярно-кінетичною і молекулярно-потенціальною енергіями.
Зміна внутрішньої енергії тіла завжди пов’язана з його взаємодією з іншими тілами із навколишнім середовищем. Людська практика і наукові дослідження переконують у тому, що зміни внутрішньої енергії тіла можуть відбуватися за рахунок виконання над тілом роботи або внаслідок теплопередачі.
Кількість переданої від одного тіла до другого енергії називають по різному залежно від способу передачі.
Якщо способом передачі служить виконання механічної роботи, то кількість переданої енергії так і називають – роботою. Якщо енергія передається внаслідок теплопередачі, то передану енергію називають кількістю теплоти —Q. Таким чином, кількість переданої чи отриманої тілом теплоти разом з виконаною роботою є мірою зміни внутрішньої енергії тіла чи системи тіл.
2) Обмін внутрішньою енергією між тілами і навколишнім середовищем або між частинами тіла без виконання механічної роботи називається теплообміном.
Теплообмін здійснюється через теплопровідність, конвекцію і випромінювання.
Теплопровідність — це передавання внутрішньої енергії від одних частин речовини до інших, обумовлене хаотичним рухом молекул і інших частинок речовини.
Теплообмін, який відбувається при перемішуванні нерівномірно нагрітих шарів рідини або газу внаслідок дії сили тяжіння, називається конвекцією.
Випромінювання тіла, яке визначається тільки його температурою, називається тепловим випромінюванням.
Коли зміна внутрішньої енергії відбувається лише за рахунок теплопередачі, на основі закону збереження енергії можна твердити, що
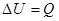
Під час нагрівання або охолодження тіла кількість переданої теплоти прямопропорційна масі тіла і зміні його температури: 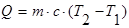 .
.
Величина С, яка характеризує залежність зміни внутрішньої енергії тіла при нагріванні або охолоджені від роду речовини і від зовнішніх умов, називається питомою теплоємністю речовини. Вона вимірюється кількістю теплоти, необхідної для нагрівання одиниці маси речовини на одиницю температури.
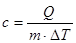 ;
; 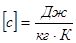
Величина, яка вимірюється кількістю теплоти, необхідної для нагрівання тіла на одиницю температури називається теплоємністю.
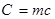 ;
; 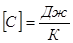 ;
; 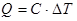 .
.
При частому теплообміні ніяких інших змін внутрішньої енергії не відбувається, тому скільки теплоти віддають одні тіла, стільки ж набувають інші. Всі розрахунки роблять за допомогою рівняння теплового балансу: при теплообміні сума кількостей теплоти, відданих усіма тілами, в яких внутрішня енергія зменшується, дорівнює сумі кількостей теплоти, одержаних усіма тілами, в яких внутрішня енергія збільшується.
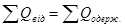
Теплообмін відбувається доти, поки температури тіл не зрівняються. загальну температуру після теплообміну позначають Q (грецька “тета”).
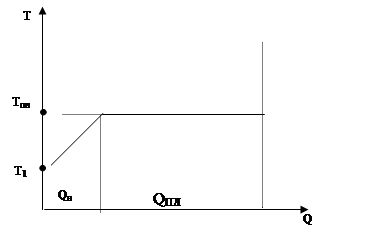
3) Ми розглядали з вами процеси пароутворення і кипіння. З’ясуємо, як визначити кількість теплоти, необхідної для перетворення в пару якої-небудь рідини за допомогою процесу кипіння.
Оскільки рідина кипить при точці кипіння 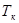 , а її початкова температура
, а її початкова температура 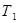 , її треба спочатку нагріти до
, її треба спочатку нагріти до 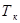 , а потім випарити.
, а потім випарити.
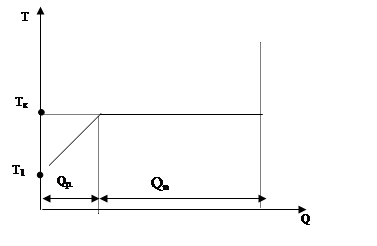
Qp— ця теплота потрібна для нагрівання рідини до точки кипіння: 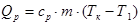 .
.
Qn— теплота потрібна для перетворення рідини в пару без зміни температури: 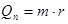 .
.
Загальна кількість теплоти визначається співвідношенням
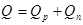
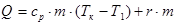
Питому теплоту пароутворення r знаходять з дослідів за допомогою рівняння теплового балансу.
Покажемо це для води:
Беруть колориметр з водою при температурі Т1. Водяну пару, що має температуру Тк=373К з кип’ятильника вводять у холодну воду калориметра, де вона конденсується. Через деякий час вимірюють кінцеву температуру Q і складають рівняння теплового балансу:
а) Теплоту дістають калориметр і вода
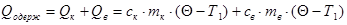
б) Віддають теплоту пара при конденсації і утворена з неї вода при охолоджені від Тк до Q.
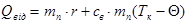
Оскільки Qодерж = Qвід.
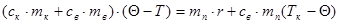
 З цього рівняння і знаходять r.
З цього рівняння і знаходять r.
4) Перехід речовини з твердого стану в рідкий називається плавлення, а перехід з рідкого стану в твердий — твердненням або кристалізацією.
При плавлені твердої речовини збільшується відстань між частинками, які утворюють кристалічну решітку, і сама решітка руйнується. Це означає, що в процесі плавлення збільшується молекулярно-потенціальна енергія речовини. Отже, самовільно речовина плавиться не може, бо на цей процес має затрачатися енергія. Плавлення тіл відбувається при строга визначеній температурі: с початку тіло треба нагріти до його температури плавлення 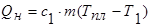 .
.
Після досягнення температури плавлення вся підведена до тіла енергія йде на збільшення потенціальної енергії молекул і подолання зв’язків між ними, а їх кінетична енергія (отже і температура тіла) залишається незмінною.
Кількість теплоти l, необхідна для перетворення 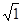 кристалічної речовини при температурі плавлення в рідину при тій самій температурі, називають питомою теплотою плавлення.
кристалічної речовини при температурі плавлення в рідину при тій самій температурі, називають питомою теплотою плавлення.
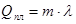
 Така сама кількість теплоти виділяється при твердненні.
Така сама кількість теплоти виділяється при твердненні.
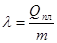 ;
; 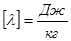
Процеси теплообміну в яких відбувається плавлення і тверднення, розраховують за рівнянням теплового балансу.
Наприклад, визначимо питому теплоту плавлення льоду колориметром. Кинемо в колориметр з водою шматочок льоду при температурі плавлення — Тпл. Припустимо, що коли весь лід розтанув, в калориметрі встановилась температура Q. Тоді можна вважати, що лід одержав теплоту, коли танув, а утворена з нього вода,— коли нагрівалась. Тобто
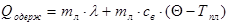
Віддавали теплоту вода і калориметр.
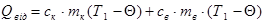
Оскільки 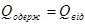 :
:
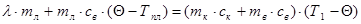
З цього рівняння обчислюємо l.
5) Речовини, які використовують добування тепла, називають паливом. паливо буває тверде, рідке і газоподібне.
Дослід показує, що кількість теплоти, яка виділяється в процесі спалювання палива, прямопропорційна масі палива: 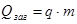 .
.
Величина q, яка характеризує залежність теплоти, що виділяється при спалювані палива, від його виду, називають питомою теплотою згоран
 2014-02-03
2014-02-03 2560
2560