A-лактоза
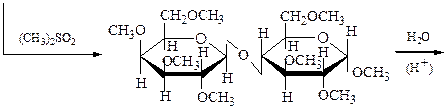
октаметиллактоза
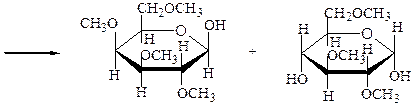
2,3,4,6-тетра-О-метил-b,D- 2,3,6-три-О-метил-a,D-
-галактопираноза -глюкопираноза
Синтез белков - многоступенчатый процесс, связанный с определенными субклеточными структурами: ядром, ядрышком, эндоплазматическим ретикулумом, рибосомами и продуктами их функционирования (ферментами).
Синтез белка - строго контролируемый процесс, и для его обеспечения необходима энергия, протекает в рибосомах, которыесостоят из двух субъединиц, взаимодействие которых происходит в присутствии ионов Мg2 + и зависит от их концентрации. Субъединицы образованы молекулами рРНК и белками. Рибосомы (обычно 4-12 рибосом) связываются через 308 (408) субъединицы с молекулой мРНК и, таким образом, образуются полирибосомы, или полисомы. Синтез белков, которые должны быть экскретированы из клетки, протекает на рибосомах, связанных с эндоплазматическим ретикулумом. В микробной клетке находится около 104 рибосом, а в клетке млекопитающих - около 105. мРНК синтезируется в ядре на матрице ДНК в виде одноцепочечной РНК высокой молекулярной массы (до 1-Ю7). Вначале синтезируется РНК, которая содержит как нуклеотидные последовательности, необходимые для синтеза определенного белка, так и ряд избыточных нуклеотидов; она обозначается как hпРНК (гетерогенная ядерная РНК). В ядре hпРНК связана со специфическими глобулярными белками (информатинами), образуя комплекс, называемый информофером. Действие на этот комплекс нуклеаз приводит к отщеплению избыточных нуклеотидов и образованию мРНК. В результате этого процесса заключенная в мРНК информация становится доступной. Для каждой аминокислоты существует по крайней мере одна тРНК. Для многих аминокислот существует до пяти различных тРНК. Молекулы тРНК содержат ряд необычных (минорных) оснований. Определение первичной структуры ряда тРНК позволило предсказать их пространственную структуру. Это структура клеверного листа, которая состоит из трех нуклеотидных петель. Из-за присутствия минорных оснований в петлях нет комплементарности с противоположной цепью. Одна из этих петель несет так называемый антикодон. Рибосомальные белки синтезируются в цитоплазме и переносятся в ядро, где они взаимодействуют с предшественником рРНК.
Синтез белка протекает в несколько стадий
1. Активация аминокислот специфическими синтетазами и их связывание с тРНК. Для синтеза белка необходимо наличие достаточного количества всех аминокислот. Синтез полипептида начинается с 5'-ОН-концамРНК.
2. Биосинтез пептидной цепи начинается в присутствии инициирующих факторов F1, F2 и F3 (все факторы являются белками). мРНК, инициаторной тРНК, GТР, Мg2+ и рибосомалных субъединиц с коэффициентами седиментации 30 S и 50 S.
3. Образование пептидной связи и рост белковой цепи. Этот процесс происходит в несколько стадий,
а) Ориентация отдельных АА-тРНК вдоль мРНК и их взаимодействие с рибосомой (в участке А); Для связывания необходимы СТР и цитоплазматический белок Т. Для того чтобы произошло связывание, в молекуле соответствующей тРНКАА. присутствовать антикодон, т.е. триплет оснований с составом, комплементарным триплетному мРНК.
б) Образование пептидной связи (или удлинение существующей пептидной цепи на одну аминокислоту под действием пептидилтрансферазы).
в) Перемещение пептида, связанного через последнюю тРНК, в участке А рибосомы на участок Р, и высвобождение предыдущей тРНК из ее связи с мРНК в участке Р (транслоказа и СТР). В то же время продвижение мРНК вдоль рибосомы на один кодон.
4) Отделение пептидной цепи от рибосомы происходит в том месте, где на молекуле мРНК «стоп» (или «бессмысленный») кодон (и А А, 11 АО или 11ОА). По мере роста цепи она свертывается с образованием вторичной и третичной структур.
Скорость синтеза белка определяется скоростью трансляции и составляет в ретикулоцитах около 1 триплета в 1 с и около 7-10 триплетов в 1 с в случае Esсherichia coli. Данные, полученные в последнее время позволяют увеличить эту цифру до 100 пептидных связей в 1 с. Ошибка при трансляции кодонов мене: Для образования пептидной связи расходуется энергия трех макроэргических связей (АТР, ОТР, пирофосфат).
История развития теории биосинтеза белка берёт своё начало ещё в 1886 году. Впервые Данилевским была представлена гипотеза обращения протеолиза. В дальнейшем идеи трансформировались в гипотезу транспептидирования. В середине 20 века, в связи с широким внедрением в биохимию метода радиоактивных индикаторов возникла теория подстановки аминокислот.
Матричный механизм биосинтеза белков. Общая схема матричного биосинтеза белковых тел представлена на рис.
Она складывается из трех подготовительных процессов — переноса вещества, энергии и информации в рибосому, и главного центрального процесса — сборки полипептидных цепей в рибосоме.

Один из элементов указанной схемы (правая верхняя часть рисунка) - транскрипция (переписывание) информации о порядке расположения аминокислотных остатков в молекуле синтезируемого белка. Известно, что информация об этом закодирована в генетическом аппарате клетки последовательностью дезоксирибонуклеотидных остатков в молекуле ДНК. Будучи преобразована (транскрибирована) в последовательность рибонуклеотидных остатков в информативной части молекулы мРНК, синтезированной на ДНК в качестве матрицы, эта информация о первичной структуре белка поступает в рибосому. Здесь она переводится (транслируется) с полинуклеотидной последовательности в аминокислотную последовательность новообразуемого в рибосомальном аппарате белка. Два другие процесса — перенос вещества (18 протеиногенных аминокислот и двух амидов) и перенос энергии, необходимой для синтеза пептидных связей (левая верхняя часть рисунка), равно как и наиболее сложный процесс — сборка полипептидной цепи в активной, транслирующей рибосоме (центральная часть рисунка), нуждаются в детальной характеристике. Она дана ниже.
Активирование аминокислот и перенос их в рибосому. Синтез пептидной связи из свободных аминокислот протекает с погло щением энергии в количестве около 12 кДж/моль.
Первый ее этап состоит во взаимодействии аминокислоты с АТФ, в результате чего возникает аминоациладенилат и выделяется пирофосфат. Гидролитический распад последнего при участии пирофосфатазы обеспечивает необратимость реакции образования аминоациладенилата. Каталитическое ускорение активирования каждой протеиногенной аминокислоты осуществляется собственным, специфичным только для данной аминокислоты ферментом. В процессе аминоацилирования тРНК легко возникают тройные фермент-субстратные комплексы. Таким образом в процессе активирования неуклонно обеспечивается строго избирательное присоединение каждой аминокислоты к специфичной для нее тРНК и создание набора аминоацил-тРНК, непосредственно поставляющих энергетически обогащенные аминокислотные остатки в рибосому. Активирование аминокислот сопровождается их кодированием (шифрование): после присоединения к соответствующей тРНК аминокислота получает код, или шифр, в виде строго специфичного только для данной аминокислоты чередования трех нуклеотидных остатков в антикодоновой петле тРНК (см. гл. VI). Этот триплет оснований называется антикодоном. Ему соответствует комплементарный кодон в составе мРНК. Взаимодействие кодонов мРНК с антикодонами аминоацил-тРНК предопределяет порядок чередования аминокислотных остатков в синтезируемом по матричной схеме белке.
Матричный механизм сборки полипептидной цепи. Биосинтез белков во всех структурных элементах клетки (ядро, митохондрии, хлоропласты, эндоплазматический ретикулум и др.) идет на рибосомах. Поэтому именно на пути исследования структуры и свойств рибосом, а также механизма их взаимодействия с исходными для биосинтеза белков соединениями достигнуты наиболее впечатляющие результаты в выявлении закономерностей новообразования белковых тел.
Синтез белка (трансляция)
Синтез белка кодируется структурными генами; информация, содержащаяся в этих генах, определяет первичную структуру белка. Первоначально информация передается на мРНК; последние, соединяясь с рибосомами, образуют комплексы — полисомы, на которых и протекает синтез полипептидных цепей. Трансляция осуществляется в соответствии с генетическим кодом, представляющим собой своеобразный текст, записанный в нуклеиновой кислоте с помощью четырех нуклеотидов и предоставляющий информацию о белковом тексте, включающем 20 аминокислот. Большая часть информации о механизме биосинтеза белка была получена в опытах с бактериями.
Прежде чем перейти к рассмотрению деталей процесса трансляции, необходимо отметить его следующие особенности. Во-первых, важную роль в биосинтезе белка играют активация аминокислот и образование их комплексов с тРНК. Во-вторых, в основе трансляции, осуществляемой рибосомами, лежит спаривание оснований трех нуклеотидов (триплетов) мРНК, получивших название кодонов, и комплементарных им триплетов тРНК — антикодонов. В-третьих, исключительно важным фактором в синтезе белка является феномен двойной специфичности ферментов, участвующих в трансляции. Это четко видно на примере действия аминоацил-тРНК-синтетаз; каждая из них, с одной стороны, высокоспецифична к определенной аминокислоте, а с другой — к определенной тРНК. Именно двойная специфичность синтетаз обеспечивает реализацию генетического кода.
Основные свойства и функции генетического кода. Исследования, проведенные Ф. Криком и С. Бреннером, позволили установить следующие основные свойства генетического кода:
1. Код триплетен: каждой аминокислоте соответствует набор, содержащий три нуклеотида. Это легко заключить из следующего рассуждения. Поскольку каждая молекула ДНК и соответственно мРНК содержит четыре вида оснований, то в случае кодирования одним основанием одной аминокислоты могли бы быть детерминированы только четыре аминокислоты. При кодировании одной аминокислоты набором из двух оснований можно детерминировать лишь 16 аминокис-
лот (42=16). Поскольку в состав белка входят 20 аминокислот, то ясно, что одна аминокислота должна кодироваться группой, содержащей не менее чем три основания (43 = 64). Действительно, экспериментально было установлено, что одну аминокислоту кодирует группа из трех оснований - - триплет. Эта группа нуклеотидов получила название кодон. Кодоны называют смысловыми, если они соответствуют какой-нибудь аминокислоте, и бессмысленными (незначащими), если они никакой аминокислоты не кодируют.
2. Были открыты все 64 кодона: 3 осуществляют стадию терминации
при синтезе белка: 1ТАА, 1ТАС, ПСА; они не кодируют в норме ни одну
аминокислоту; 61 — кодируют аминокислоты, т.е. на каждую из 20 ами
нокислот приходится около 3 кодонов. Иными словами, генетический
код вырожден (избыточен): одной аминокислоте соответствует более чем
один кодон. Бывает 2, 3, 4 и 6-кратная вырожденность.
3. Код специфичен: каждую аминокислоту детерминируют только
определенные кодоны, которые не могут быть использованы для дру
гой аминокислоты.
Генетический код может быть перекрывающимся и неперекры
вающимся. В случае перекрывающегося кода триплет АБВ кодирует
аминокислоту акр триплет БВГ — аминокислоту ак2, триплет ВГД -
аминокислоту ак3. В случае неперекрывающегося кода основания каж
дого триплета специфичны только к одной аминокислоте.
Исследования показали, что генетический код, за исключением редких случаев, является неперекрывающимся.
4. Коллинеарность кода: последовательность кодонов мРНК одно
значно определяет последовательность аминокислот в полипептидной
цепи. Основания мРНК считываются с определенной точки (напри
мер, с триплета АБВ) и строго последовательно. Другими словами:
код называют ко л линеарным, если кодоны располагаются в том же
порядке, что и остатки кодируемых ими аминокислот. Допустим, что
з какой-либо точке мРНК произошла мутация: удаление (делеция)
или вставка какого-либо основания.
Первые две аминокислоты полипептидной цепи остаются те что и в цепи схемы 1. При дальнейшем наращивании полипепт: цепи в связи с изменением состава оснований триплетов будут г мать участие иные аминокислоты ак3*, ак4*, ак5*. В результате во: кает так называемый сдвиг рамки считывания оснований.
6. Генетический код универсален: один и тот же код используе-т: - всеми видами живых организмов. Некоторые отклонения были ружены только для ДНК митохондрий, что представляет интере: точки зрения эволюции данных органелл.
Репрессия синтеза белка осуществляется с помощью специфического вещества — репрессора. Каждый репрессор блокирует синтез какого-либо одного или нескольких определенных белков. Репрессоры имеют белковую природу. Их структуру определяет ген-регулятор, который может существовать автономно от регулирующей системы. В молекуле репрессора находятся два центра связывания: один — с индуктором, другой — со специфическим участком ДНК. Связываясь с определенными участками молекулы ДНК, репрессор блокирует инициацию транскрипции мРНК. Специфический участок ДНК, с которым связывается репрессор, называется оператором. Однако репрес-соры не всегда способны связываться с оператором и блокировать синтез мРНК. Они могут существовать как в активной, так и в неактивной формах. Если репрессор взаимодействует с индуктором, он инак-тивируется и не способен взаимодействовать с оператором. В отсутствие индуктора репрессор прочно связывается с оператором.
Ген, кодирующий синтез белка, называется структурным геном. В некоторых случаях репрессор может контролировать действие только одного гена, однако один и тот же репрессор может воздействовать и на несколько генов. Так, в уже отмеченном нами выше синтезе Р-галактозидазы, пермеазы и трансацетилазы репрессор контролирует транскрипцию трех генов.
Поскольку все три белка необходимы для утилизации лактозы и накапливаются они в клетках Е. соИ в строго определенных соотношениях, их синтез осуществляется координированно благодаря тому, что три гена расположены рядом, вследствие чего структурная информация для трех ферментов транскрибируется в виде одной молекулы мРНК. Участок молекулы ДНК, кодирующий одну молекулу мРНК и содержащий один контролирующий оператор, представляет собой структурную единицу, называемую опероном. В опероны могут входить один, два или несколько структурных генов. В этой структурной единице оператор очень близко расположен к месту, где начинается транскрипция мРНК; он тесно сцеплен со структурными генами.
В состав оперона входит также определенная последовательность нуклеотидов, примыкающая непосредственно к оператору; она называется промотором. В совокупности с репрессором оператор препят ствует процессу синтеза мРНК. Промотор выполняет функцию инициации этого синтеза, является местом связывания РНК-полимеразы. Блокирование оператора репрессором препятствует связыванию РНК-полимеразы с промотором. В опытах по утилизации лактозы клетками Е. соИ установлено, что лактозный промотор слегка перекрывается оператором и поэтому репрессор при связывании с оператором блокирует промотор и препятствует его связыванию с РНК-полимеразой.
 2014-02-03
2014-02-03 2258
2258