Биосинтез белка (трансляция), как и активация аминокислот, происходит в цитоплазме. Он осуществляется на нуклеопротеидных частицах – рибосомах.
Рибосомы эукариот состоят из двух различных субъединиц, каждая из которых построена из рибосомальной РНК. Рибосомы и их субчастицы классифицируются не по массе, а по коэффициенту седиментации (осаждение при центрифугировании). Так, коэффициент седиментации полной эукариотической рибосомы составляет 80S, а ее субчастиц 40S и 60S соответственно. Рибосомы прокариот имеют аналогичную структуру, но состоят из субчастиц с коэффициентом седиментации 30 и 50S и с общим коэффициентом седиментации 70S.
Клетки, в которых происходит активный биосинтез белков, часто содержат рибосомы, расположенные одна за другой на мРНК (как жемчужины на нитке). Такая структура называется полисомой.
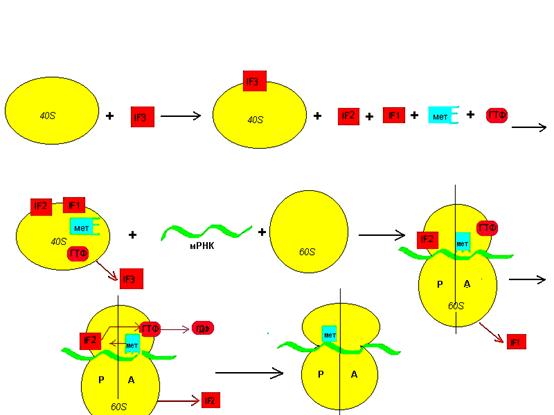
Первым этапом синтеза белка является инициация. Активное участие в инициации отводится специальным белковым факторам IF1, IF2, IF3. На первой стадии в работу включается инициации фактор 3 –IF3. Из скопления субъединиц он выбирает малую (40S или 30S), закрепляется на ней, тем самым, вызывая конформационные изменения, способствующие вхождению 4-х компонентов: инициации фактора 1 (IF1), инициации фактора 2 (IF2), ГТФ, тРНК-метиониновой у эукариот или тРНК –формилметиониновой у прокариот.
Выполнив свою функцию IF3 сбрасывается с субчастицы.
Следующим в работу включается IF1, он способствует вхождению в субчастицу мРНК. Именно нахождение в субчастице тРНК-метиониновой определяет положение мРНК. Здесь работает кодон-антикодоновое взаимодействие. Вторая функция IF1 – присоединение большой субъединицы. Выполнив эту функцию, фактор сбрасывается с рибосомы.
Оставшийся белковый фактор IF2 способствует с одной стороны закреплению мРНК на рибосоме, с другой – активирует гидролиз ГТФ. Энергия гидролиза расходуется на передвижение мРНК и тРНК-метиониновой в пептидильный (Р) центр рибосомы и сбрасыванию с нее продуктов гидролиза. По окончанию процесса инициации образуется транслирующая рибосома.
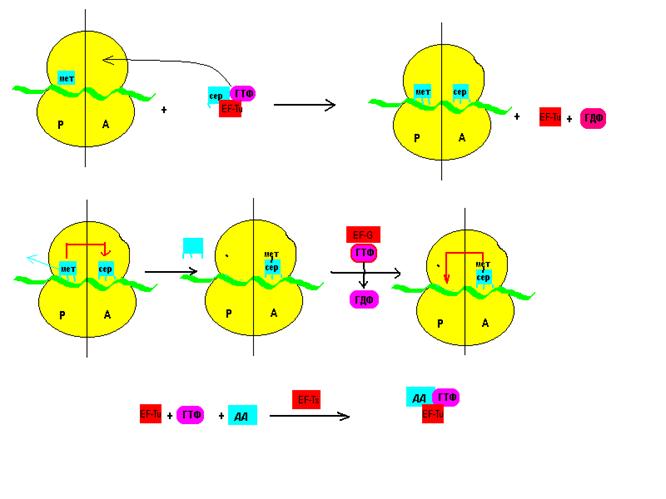
Вторым этапом биосинтеза белка является элонгация. В процессах элонгации также принимают активное участие белковые факторы: элонгации фактор Tu (ЕF-Tu), элонгации фактор Ts (EF- Ts), элонгации фактор G (EF- G).
Элонгацию условно можно разделить на три этапа. На первом этапе в аминоацильный (А) участок приходит тРНК – другой аминокислоты в комплексе с ГТФ и TF-Tu. Функция белкового фактора – гидролиз ГТФ. До гидролиза взаимодействие тРНК и мРНК очень слабое. Таким образом, гидролиз ГТФ при участии белкового фактора EF-Tu является лимитирующим фактором, дающим время для проверки правильно ли связана тРНК.
Белковый фактор EF- Ts катализирует процесс восстановления ГТФ и воссоздания комплекса ГТФ-EF-Tu.
На следующем этапе происходит синтез дипептида. Под действием фермента транспептидазы (пептидилтрансферазы) происходит перенос первой аминокислоты (метионин) в аминоацильный участок и образование пептидной связи. Данный процесс протекает без участия АТФ. После образования пептидной связи тРНК первой аминокислоты покидает пептидильный (Р) участок.
На следующей стадии EF- G, находящийся в комплексе с ГТФ, гидролизует последний. Энергия гидролиза расходуется на перемещение дипептида в пептидильный участок. Аминоацильный участок остается свободным, и цикл может повторяться.
Когда один из стоп-кодонов попадает в аминоацильный участок, наступает терминация. Для стоп-кодонов нет специфических тРНК Вместо аминокислот с рибосомой связываются два белковых высвобождающих фактора (RF1 и RF2). Один из них RF1 катализирует гидролитическое расщепление эфирной связи между тРНК и С-конц. Пептида, тем самым, высвобождая белок. После этого транслирующая рибосома распадается на составные части. В диссоциации рибосомы используется энергия гидролиза ГТФ, который протекает с участием RF3.
Образовавшийся белок является «сырым». Его созревание связано с отщеплением первой аминокислоты – метионина (формилметионина) или короткого олигопептида.
Синтез белка требует высоких энергетических затрат. При приосоединении одной аминокислоты затрачивается 4 макроэргических связи, две АТФ затрачиваются при активации (АТФ ---АМФ + 2 неорг. Фосфата) и две ГТФ на стадии элонгации. Кроме того, на стадии инициации и терминации расходуется по одной ГТФ.
 2014-02-03
2014-02-03 761
761







