— С середины прошлого столетия ВОЗ стремится повысить доступность лекарственных средств широким слоям населения не только в развитых странах, но и в развивающихся и отсталых, только освободившихся от колониального гнёта.
— До этого времени новые лекарственные средства оставались привилегией развитых стран. Для других стран они были предметом импорта.
Производство генериков позволяет:
— Повысить доступность населения к новым (относительно) ЛП по их ассортименту;
— Повысить доступность населения к новым ЛП по их стоимости, т.к. при производстве генериков исключаются затраты на изучение фармакологического действия, токсичности, безопасности.
Внедрение воспроизведённых препаратов (или генериков) вызвало появление новых проблем.
— Это обеспечение качества, эффективности и безопасности
Три этих критерия не обязательно соединяются в одном препарате.
— Препарат может быть безопасным, но неэффективным;
— Препарат может быть эффективным, но небезопасным;
— Препарат может быть качественным, но неэффективным и небезопасным.
Для новых препаратов нужно доказательства всех трех критериев: безопасности, эффективности и качества.
Для генериков нужны доказательства возможности замены ими оригинальных препаратов с сохранением их эффективности.
Генерики в настоящее время играют важную роль в здравоохранении.
В развитых странах их доля в здравоохранении ~ 10%, в развивающихся ~ 30%, в странах с переходной экономикой до 50%, в самых бедных – 60-70%.
Потенциальная возможность генериков:
— Обеспечивается широкий доступ населения к ЛС;
— Экономия средств по сравнению с закупкой инновационных ЛС.
Все три критерия: качество, эффективность и безопасность для генериков в сравнении с инновационным препаратом объединяются в одно понятие – биоэквивалентность.
Биоэквивалентность включает два аспекта:
— Генерики должны быть терапевтически эквивалентными инновационным препаратам;
— Генерики должны соответствовать таким же стандартам безопасности, эффективности и качества, как и инновационные.
— Биоэквивалентными являются два ЛС, если они являются фармацевтически эквивалентными или фармацевтически альтернативными и если их биодоступность в максимальной концентрации и времени ее достижения (Сmax и Тmax), а также площади под кривой (АUС) – после назначения одинаковой молярной дозы, являются настолько схожими, что можно ожидать одинакового терапевтического эффекта.
Альтернативные ЛС - это препараты, содержащие одинаковые молярные дозы вещества, но отличающиеся лекарственной формой (таблетки – капсулы)
Фармацевтически эквивалентными считаются препараты, содержащие одинаковое количество вещества, в одинаковых лекарственных формах (назначаемые одним и тем же путем).
Определение биоэквивалентности является основным требованием при регистрации генериков
Для оценки биоэквивалентности используются различные методики:
— Сравнительные фармакокинетические методики, в которых активный фармацевтический ингредиент определяется как функция времени в различных биологических жидкостях для определения фармакокинетических показателей в виде АUС и Сmax (участием людей);
— Сравнительные фармакодинамические исследования (с участием людей);
— Сравнительные клинические исследования;
— Сравнительные исследование in vitro.
Не проводят определение биоэквивалентности
— Парентеральные ЛП с одним и тем же активным фармингредиентом в той же молярной концентрации (отличаются буф. раствором, консервантом);
— Пероральные ЛП с теми же условиями;
— Порошки для приготовления растворов;
— Капли для уха и носа (те же условия);
— ЛП для местного применения (те же условия);
— Водные растворы для ингаляций (те же условия)
Обязательно проверять биоэквивалентность:
— Для ЛП перорального применения с немедленным высвобождением;
— Для неотложной помощи;
— Для ЛП с малой терапевтической широтой;
— Для ЛП, имеющих проблемы (документально подтвержденные), связанные с АФИ.
Выбор препарата сравнения для изучения биодоступности в соответствии с рекомендациями ВОЗ.
— Зарегистрированный инновационный препарат;
— Препарат сравнения ВОЗ, первичное место которого зарегистрировано в списке ВОЗ;
— Инновационный препарат, зарегистрированный в стране с надлежащим регламентом и приобретенный там же
— Биоэквивалентность может быть доказана фармакокинетическими, фармакодинамическими, клиническими исследованиями, исследованиями in vitro.
Исследования in vitro (биовейвер)
— Биовейвер относится к порядку государственной регистрации, когда заявка (досье) утверждается, основываясь на доказательстве эквивалентности путем исследования профилей растворения.
Биовейвер – заменитель исследования биоэквивалентности некоторых категорий ЛС для перорального применения
В соответствии с системой биофармацевтической классификации (СБК) по растворимости и степени проникновения вещества АФИ делят на 4 класса:
1. Высокая растворимость, высокая степень проникновения;
2. Низкая растворимость, высокая степень проникновения;
3. Высокая растворимость, низкая степень проникновения;
4. Низкая растворимость, низкая степень проникновения.
Методика проведения испытаний биоэквивалентности in vitro (биовейвер)
1. Выбрать препарат сравнения - референтный препарат (Список ВОЗ, в РФ – нет);
| Примеры референтных ЛС | |||
| Лекарственное вещество | Референтная ЛФ | Страна | Фирма |
| Атенолол | Тенормин, табл. 50 мг | Великобритания | Astra-Zeneca |
| Лоперамид | Ренитек, табл. 20 мг | США | Merck-Sharp |
| Примеры испытуемых и референтных ЛС | |||
| Испытуемое ЛС | Референтное ЛС | ||
| Амлодипин, таб. 5 мг «Озон» | Амлодипин Сандоз, 5 мг «Сандоз», Словения | ||
| Ибупрофен, таб.200 мг, ОАО «Синтез» | Ибупрофен, «Хемофарм», Сербия |
2. Изучить растворимость и проницаемость активного ингредиента.
Растворимость определяют при значениях pH 1,2; 4,5; 6,8.
Температура – 37±1ºС. Рассчитывают отношение между максимальной дозой и растворимостью D/S.
Заключение: высокая растворимость D/S<250;
низкая растворимость D/S>250.
Проницаемость получена при испытаниях in vivo.
высокая проницаемость 85% и более;
низкая проницаемость – менее 85%.
3. Изучение профилей растворения генерика и препарата сравнения
Растворение проводят в буферных растворах с pH 1,2; 4,5; 6,8.
Отбор проб проводят в нескольких точках (не менее 3-х).
Обычно 10, 15, 20, 30, 45 мин. Последняя точка – время, когда в раствор переходит 90% ЛВ.
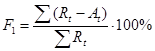 Строят профили растворения:
Строят профили растворения:
Математическая оценка профилей растворения
— 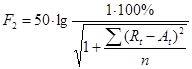 Фактор различия - F1
Фактор различия - F1
Если F1 в пределах 0-15%, то ЛС можно считать эквивалентными
— Фактор сходимости – F2
ЛС эквивалентны - если F2 от 50 до 100.
Примечание: Если за 15 мин более 85% вещества переходит в раствор, расчеты F1 и F2 не делают
— Очень быстро растворимые – 85% вещества переходит в среду за 15 минут;
— Быстро растворимые – 85% вещества вещества переходит в среду за 30 минут;
— Медленно растворимые – 85% вещества вещества переходит в среду более чем за 30 минут.
4. Изучение информации о вспомогательных веществах
Вспомогательные вещества не должны оказывать влияния на процессы всасывания
5. Изучение возможных рисков
В случае возможного побочного действия принимается решение о возможности использования биовейвер или in vivo.
6. Заключение об эквивалентности
При принятии заключения учитывают:
— скорость растворения;
— профиль высвобождения;
— оценку вспомогательных веществ;
— оценку рисков.
 2014-02-03
2014-02-03 863
863






