Пример 2.3.3.
Рассчитать энтальпию реакции гидролиза мочевины, если даны стандартные энтальпии образования компонентов:
DH0298 (CO2) = - 393.53 кДж/моль, DH0298 [CO(NH2)2] = - 332.85 кДж/моль,
DH0298 (H2O ж.) = - 285.57 кДж/моль, DH0298 (NH3) = -48.19 кДж/моль.
Решение.
Гидролиз мочевины описывается уравнением:
CO(NH2)2 (т.) + H2O (ж.) = CO2 (г.) + 2 NH3 (г.)
DH0298 х.р. = DH0298 (CO2) + 2DH0298 (NH3) - DH0298 (H2O) - DH0298 [CO(NH2)2]
DH0298 х.р. = - 393.52 + 2 (- 48.19) - (- 285.57) - (- 332.85) = 119.52 кДж/моль.
Пример 2.3.4.
Рассчитать энтальпию образования бензола, если известны энтальпии сгорания бензола, углерода и водорода.
DH0298 сг. (С) = DH0298 обр. (СО2) = - 393.52 кДж/моль,
DH0298 сг. (Н2) = DH0298 обр. (Н2О) = - 285.57 кДж/моль,
DH0298 сг. (С6Н6) = - 3264.6 кДж/моль.
Решение.
Уравнение реакции образования бензола из простых веществ имеет вид:
6 С(графит) + 3Н2 (г.) = С6Н6 (ж.)
DH0298 х.р. = 6 (- 393.52) + 3 (- 285.57) - (- 3264.6) = 50.55 кДж/моль.
2.4. Второе начало (закон) термодинамики.
Второй закон термодинамики позволяет найти критерии, определяющие направление самопроизвольных процессов.
Второй закон имеет более ограниченную область применения и носит статистический характер, т.е. применим к системам, состоящим из большого числа частиц.
Энтропия системы.
Критерием направления процессов в изолированных системах является энтропия S. Понятие энтропии введено Клаузиусом. Для обратимого изотермического процесса:

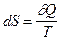 (2.5)
(2.5)
Поскольку в изолированной системе отсутствует теплообмен, т.е. dQ = 0, то
dS ³ 0.
Тогда второе начало термодинамики для изолированной системы может быть сформулировано:
В изолированной системе самопроизвольно могут совершаться только такие процессы, при которых энтропия системы возрастает.
В рамках статистической природы второго закона определена статистическая природа энтропии. Согласно Больцману, энтропии - это мера беспорядка в системе
S = k lg W (2.6)
где k = 1.38*10-23 Дж/К (постоянная Больцмана),
W - термодинамическая вероятность системы, которая определяется числом микросостояний, с помощью которых можно реализовать данное макросостояние системы.
В соответствии с физическим смыслом энтропии, W возрастает при переходе от твердого состояния вещества в жидкое и газообразное. Так, значение энтропии SO3 в газообразном, жидком и твердом состояниях равны соответственно 243.3; 95.76 и 52.3 Дж/мольК. Энтропия зависит от строения вещества: чем сложнее частица, тем больше энтропия.
S (O) = 160.9; S (O2) = 204.8; S (O3) = 268.7 Дж/мольК.
Энтропия системы возрастает при нагревании и уменьшении давления.
Абсолютные величины энтропии чистых веществ при стандартных условиях S0298 вычислены и сведены в таблицы (см. приложение).
В ходе химической реакции изменение энтропии DS х.р. вычисляется на основе закона Гесса:
DS х.р. = (åDS0298)прод. - (åDS0298)исх. в-в. (2.7)
Пример 2.4.1
Рассчитать изменение энтропии для реакции:
H2 (г.) + Cl2 (г.) = 2 НСl (г.)
DS0298 х.р. = 2 S0298 (НСl) - (S0298 (Н2) + S0298 (Сl2))
На основании данных таблицы приложения находим:
DS 0298 х.р. = 2 *186.79 - 131.00 + 222.98 = 19.60 Дж/мольК
где G1 и G2 - свободная энергия Гиббса в начальном и конечном состояниях.
 2022-01-07
2022-01-07 231
231








