Варианты контрольных заданий
| Последние цифры шифра | Номера задач для контрольных работ |
| 1, 11, 21, 31, 41, 51, 61, 71, 81, 91, 101 | |
| 2, 12, 22, 32, 42, 52, 62, 72, 82, 92, 102 | |
| 1, 14, 22, 33, 44, 51, 66, 73, 85, 98, 105 | |
| 3, 13, 23, 33, 43, 53, 63, 73, 83, 93, 103 | |
| 4, 14, 24, 34, 44, 54, 64, 74, 84, 94, 104 | |
| 5, 15, 25, 35, 45, 55, 65, 75, 85, 95, 105 | |
| 6, 16, 26, 36, 46, 56, 66, 76, 86, 96, 106 | |
| 7, 17, 27, 37, 47, 57, 67, 77, 87, 97, 107 | |
| 8, 18, 28, 38, 48, 58, 68, 78, 88, 98, 108 | |
| 9, 19, 29, 39, 49, 59, 69, 79, 89, 99, 109 | |
| 10, 11, 22, 32, 43, 53, 64, 74, 85, 98, 106 | |
| 2, 12, 23, 33, 44, 54, 65, 75, 86, 96, 107 | |
| 3, 13, 24, 34, 45, 55, 66, 76, 87, 97, 108 | |
| 4, 14, 25, 35, 46, 56, 67, 77. 88, 98, 109 | |
| 5, 15, 26, 36, 47, 57, 68. 78, 89, 99, 110 | |
| 6, 16, 27, 37, 48, 58,69, 79, 90, 100, 101 | |
| 7, 17, 28, 38, 49, 59, 69, 80, 90, 91, 101 | |
| 8, 18, 29, 39, 41, 51, 62, 72, 81, 92, 103 | |
| 9, 19, 30, 40, 42, 53, 63, 73, 82, 93, 103 | |
| 10, 20. 21. 31, 43, 54, 64, 74, 83, 94, 104 | |
| 1, 12, 23, 34, 45, 56, 67, 78, 89, 100, 106 | |
| 2, 13, 24, 35, 46, 57, 68, 79, 90, 95, 107 | |
| 3, 14, 25, 36, 47, 58, 69, 80, 85, 96, 108 | |
| 4, 15, 26, 37, 48, 59, 70, 74, 86, 97, 109 | |
| 5, 16, 27, 38, 49, 60, 66, 75, 87, 98, 110 | |
| 6, 17, 28, 39, 50, 51, 61, 76, 88, 99, 101 | |
| 7, 18, 29, 40, 41, 52, 62, 77, 89, 91, 105 | |
| 8, 19, 30, 31, 42, 53, 63, 78, 90, 92, 102 | |
| 9, 20, 21, 32, 43, 54, 64, 79, 81, 93, 103 | |
| 10, 11, 22, 33, 44, 54. 64, 79, 81, 93, 103 | |
| 9, 12, 21, 39, 49, 51, 69, 71, 85, 99, 101 | |
| 8, 13, 22, 38, 48, 52, 68, 72, 84, 98, 102 | |
| 7, 14, 23, 37, 47, 53, 67, 73, 83, 97, 103 | |
| 6, 15, 24, 36, 46, 54, 66, 74, 82, 96, 104 | |
| 5, 16, 25, 35, 45, 55, 65, 75, 81, 91, 105 | |
| 4, 17, 26, 34, 50, 56, 64, 76, 89, 92, 106 | |
| 3, 18, 27, 33, 43, 57, 63, 77, 88, 93, 107 | |
| 2, 19, 28, 32, 42, 58, 62, 78, 87, 94, 108 | |
| 1, 20, 29, 31, 41, 59, 61, 79, 86, 95, 110 | |
| 6, 18, 30, 32, 44, 51, 68, 73, 82, 91, 106 | |
| 7, 19, 21, 33, 49. 52. 67. 74, 81, 92, 107 | |
| 8, 20, 22, 39, 48, 53, 66, 75, 89, 93, 108 | |
| 9, 11, 21, 38, 47, 54, 65, 76, 88, 94, 110 | |
| 10, 12, 22, 37, 46, 55, 64, 77, 87, 95, 106 | |
| 9, 13, 23, 36, 45, 56. 63, 78, 86, 91, 107 | |
| 8, 14, 24, 35, 50, 57, 62, 79. 82, 92, 108 | |
| 7, 15, 25, 34, 43, 58, 61, 73, 81, 93, 110 | |
| 6, 16, 26, 33, 42, 59, 68, 74, 90, 94, 106 | |
| 5, 17, 27, 32, 41, 51, 67, 75, 88, 95, 107 | |
| 4, 18, 28, 33, 42, 52, 68, 76, 89. 96, 108 | |
| 3, 19, 29, 34, 49, 53, 65, 77, 86, 97, 109 | |
| 1, 11, 21, 31, 41, 51, 61, 71, 81, 91, 101 | |
| 2, 12, 22. 32. 42, 52. 62, 72. 82, 92, 102 | |
| 3, 13, 23, 33, 43, 53, 63, 73. 83, 93. 103 | |
| 4, 14, 24, 34, 44, 54, 64, 74, 84, 94. 104 | |
| 5, 15, 25, 35, 45, 55, 65, 75, 85, 95, 105 | |
| 6, 16, 26, 36, 46, 56, 66, 76, 86, 96, 106 | |
| 7, 17, 27, 37, 47, 57, 67, 77, 87, 97, 107 | |
| 8, 18, 28, 38, 48, 58, 68, 78, 88, 98, 108 | |
| 9, 19, 29, 39, 49, 59, 69, 79, 89, 99, 109 | |
| 10, 20, 30, 40, 50, 60, 70. 80. 90, 100, 110 | |
| 1, 11, 22, 32, 43, 53, 64, 74, 85, 95, 106 | |
| 2, 12, 23, 33, 44, 54. 65, 75, 86, 96, 107 | |
| 3, 13, 24, 34, 45, 55, 66, 76, 87, 97, 108 | |
| 4, 14, 25, 35, 46, 56, 67, 77, 88, 98, 109 | |
| 5, 15, 26, 36, 47, 57, 68, 78, 89, 99, 110 | |
| 6, 16, 27, 37. 48, 58. 69. 79, 90, 100, 101 | |
| 7, 17, 28, 38, 49, 59, 69, 70, 80, 91, 101 | |
| 8, 18, 29, 39. 41, 51, 62, 72, 81, 92, 103 | |
| 9, 19, 30, 40, 42, 53, 63, 72, 82, 93, 103 | |
| 10. 20, 21, 31, 43, 54. 64, 74. 83, 94, 104 | |
| 1, 12, 23. 34, 45, 56. 67. 78, 89, 100, 106 | |
| 2, 13, 24, 35, 46. 57, 68. 79, 90, 99, 105 | |
| 3, 14, 25, 36, 47, 58, 69, 80, 85, 96, 108 | |
| 4, 15, 26, 37, 48, 59, 70, 74, 86, 97, 109 | |
| 5, 16, 27, 38, 49, 60, 66, 75, 87, 98, 110 | |
| 6, 17, 28, 39, 50, 51, 61, 76, 88, 99, 101 | |
| 7, 18, 29, 40, 41, 52, 62, 77, 89, 91,100 | |
| 8, 19, 30, 31, 42, 53, 63, 78, 90, 92, 102 | |
| 9, 20, 21, 32, 43, 54, 64, 79, 81, 93, 103 | |
| 10, 11, 22, 33, 44, 55, 65, 80, 82, 94, 104 | |
| 9, 12, 21, 39, 49, 51, 69, 71, 85, 99, 101 | |
| 8, 13, 22, 38, 48, 52, 68, 72. 84, 98, 102 | |
| 7, 14, 23, 37, 47, 53, 67, 73, 83, 97, 103 | |
| 6, 15, 24, 36, 46, 54, 66, 74, 82, 96, 104 | |
| 5, 16, 25, 35, 45, 55, 65, 75, 81, 91, 105 | |
| 4, 17, 26, 34, 50, 56, 64, 76, 89, 92, 106 | |
| 3, 18, 27, 33, 43, 57, 63, 77, 88, 93, 107 | |
| 2, 19, 28, 32, 42, 58. 62, 78, 87. 94. 108 | |
| 1. 20, 29, 31, 41, 59, 61. 79. 86. 95, 110 | |
| 6, 18, 30, 32, 44, 51, 68, 73, 82, 91, 106 | |
| 7, 19, 21, 33, 49, 52, 67, 74, 81, 92, 107 | |
| 8, 20, 22, 39, 48, 53, 66, 75, 89, 93, 108 | |
| 9, 11, 21, 38, 47, 54. 65, 76, 88, 94, 110 | |
| 10, 12, 22, 37, 46, 55, 64, 77, 87, 95, 106 | |
| 9, 13, 23, 36, 45, 56, 63, 78, 86, 91, 107 | |
| 8, 14, 24, 35, 50, 57, 62, 79, 82, 92, 108 | |
| 7, 15, 25, 34, 43, 58, 61, 73, 81, 99, 110 | |
| 6, 16, 26, 33, 42, 59, 68, 74, 90, 94, 106 | |
| 5, 17, 27, 32, 41, 51, 67, 75, 88, 95, 107 |
1. Строение вещества. Химическая связь. Периодический закон
и система Д.И.Менделеева
Свойства любого вещества легче всего изучить и полностью понять, если соотнести их со строением атомов и молекул, образующих это вещество. Главная задача при изучении этого раздела - научиться устанавливать зависимость между строением атома, его положением в периодической системе и физическими и химическими свойствами вещества.
Известно, что «визитной карточкой» элемента является его порядковый номер в системе Д.И.Менделеева, поскольку заряд ядра, число электронов в атоме и их распределение внутри атома определяется именно этим числом. Например, сера имеет порядковый номер 16, заряд ядра атома серы +16, и в атоме содержится 16 электронов.
Свойства элемента, в том числе и химические, зависят от того, каким образом электроны распределены в атоме, и, главным образом, от числа и состояния внешних электронов.
При заполнении атома электронами выполняются принцип минимума энергии и принцип Паули. Принцип минимума энергии заключается в следующем.: из всех возможных состояний электрон занимает то, в котором его энергия минимальна. Известно, что в атоме электроны расположены на энергетических уровнях (n=1, 2, 3...) и подуровнях, обозначаемых буквами s, p, d, f, причем число подуровней определяется номером уровня. Это значит, что на первом энергетическом уровне содержится только один подуровень - s, на втором два - s и p, на третьем три - s, p, d; и т.д.
По величине энергии электронные подуровни располагаются в следующий ряд: 1s<2s<2p<3s<3p<4s»3d<4p<5s<4d<5p<6s»5d»4f<6p<7s»6d»5f. В этой последователь-ности неоднозначными являются несколько состояний, а именно, 3d и 4s, 4d и 5s, 6s, 5d и 4f и, наконец, 7s, 6d и 5f. Энергия этих подуровней, например, 3d и 4s, может изменяться. В незаполненных орбиталях состояние 4s имеет более низкую энергию и заполняется в первую очередь, а затем происходит заполнение 3d-подуровня. В заполненных орбиталях энергия 3d-подуровня ниже, чем 4s.
Соблюдение принципа Паули приводит к тому, что емкость каждого эенргетического уровня и подуровня является вполне определенной величиной. Максимальное число электронов на энергетическом уровне вычисляется по формуле N=2n2, где n - номер уровня.
Число электронов на энергетических подуровнях следующее: s - 2 электрона, p - 6 электронов, d - 10 электронов, f - 14 электронов.
Располагая этими представлениями, можно составить распределение электронов в любом атоме (электронную формулу). Например, элемент №16. Шестнадцать электронов располагаются в атоме следующим образом: 1s22s22p63s23p4. Элемент №22 имеет структуру электронной оболочки: 1s22s22p63s23p64s23d2, элемент №37 - 1s22s22p63s23p63d104s24p65s1.
Просматривается четкая связь между электронным строением атома и его положением в периодической системе:
1. Порядковый номер элемента совпадает с числом электронов в атоме.
2. Номер периода, в котором находится элемент, совпадает с числом энергетических уровней в атоме. Например, элемент №16 находится в третьем периоде и имеет три энергетических уровня (3s23p4), элемент №22 - в четвертом периоде (4s2), элемент №37 - в пятом периоде (5s1).
3. Номер группы определяется числом валентных электронов. Валентные электроны могут находиться либо только на последнем энергетическом уровне (3s23p4 - VI группа), либо на последнем и предпоследнем уровне (3s23p2 - IV группа).
4. Элементы главных и побочных групп отличаются по заполнению электронных оболочек. У элементов главных подгрупп заполняются внешние s и p- подуровни. У элементов побочных подгрупп заполняются d и f-подуровни предпоследних уровней.
Пример 1.1. Дана электронная формула атома элемента: 1s22s22p63s23p63d104s24p3.
Решение:
1. Порядковый номер элемента - №33.
2. Элемент находится в четвертом периоде, т.к. заполнены четыре энергетических уровня.
3. Элемент находится в пятой группе, т.к. на внешнем энергетическом уровне содержится пять валентных электронов (4s24p3).
4. Элемент находится в главной подгруппе, т.к. валентные электроны содержатся на подуровнях s и p внешнего энергетического уровня.
Для оценки возможных валентных состояний атома следует исходить из спиновой теории валентности, утверждающей, что валентность элемента определяется числом неспаренных электронов в атоме, как в нормальном, так и в возбужденном состояниях.
Для этого следует изобразить электронное строение атома с помощью энергетических ячеек. Например, строение атома серы будет выглядеть следующим образом:
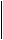
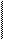

 ¯ ¯ ¯
¯ ¯ ¯
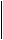
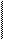
 ¯ 3p4
¯ 3p4
 ¯ ¯ ¯ 3s2
¯ ¯ ¯ 3s2
 ¯
¯
¯ 2s2 2p6
1s2
В атоме содержится два неспаренных электрона, следовательно, в нормальном состоянии валентность серы равна двум.
При сообщении атому некоторого количества энергии электронные пары внешнего энергетического уровня могут распариваться и переходить на более высокие энергетические подуровни в пределах последнего энергетического уровня (возбужденное состояние).
Для рассматриваемого атома возможны два возбужденных состояния:
 |
¯ 


 ¯ ¯ ¯ 3d
¯ ¯ ¯ 3d
¯ 3p
3s
 |
¯ 

 ¯
¯
 ¯ ¯ ¯ 3d
¯ ¯ ¯ 3d
¯ 3p
3s
В первом случае в атоме имеется четыре неспаренных электрона (4-валентное состояние), во втором - шесть неспаренных электронов (6-валентное состояние).
Химическая связь образуется при перекрывании атомных орбиталей валентных электронов, при этом связь располагается в том направлении, в котором возможность перекрывания орбиталей является наибольшей. Образуются электронные пары общие для связывающихся атомов. В образовании связей могут участвовать s, p, d электроны как в «чистом», так и в гибридном состоянии. Гибридизация валентных орбиталей имеет место тогда, когда валентные электроны атома находятся в разных подуровнях, обладают различной энергией и различной формой орбиталей. Наиболее простыми и известными являются типы гибридизации sp, sp2, sp3, которые наблюдаются у атомов бериллия, бора, углерода и их аналогов.
 2022-01-07
2022-01-07 137
137








