Пример 2.4.3.
Определите возможность протекания реакции при 250С
NH3 (г.) + HCl (г.) = NH4Cl (тв.),
если NH3 HCl NH4Cl
DH0298 кДж/моль - 46.19 - 92.30 - 315.39
D S0298, Дж/мольК 192.50 186.70 94.56
Решение.
Определяем DH0298 х.р. = DH0298 NH4Cl (тв.) - (DH0298 NH3 (г.) + DH0298 HCl (г.)) =
= - 315.39 - (- 46.19 - 92.30) = - 176.90 кДж.
Тогда изменение энтропии реакции
DS 0298 х.р. = DS 0298 NH4Cl (тв.) - (DS 0298 NH3 (г.) + DS 0298 HCl (г.)) =
= 94.56 - (- 192.5 + 186.70) = - 284.64 Дж/мольК.
По уравнению Гиббса-Гельмгольца находим изменение DG0298 х.р.
DG0298 х.р. = DH0298 х.р. - TDS 0298 х.р. = - 176.9 + 284.64*10-3 *298 = - 92.1 кДж/моль.
Так как DG0298 х.р. < 0, данная реакция термодинамически возможна (протекает самопроизвольно).
2.5. Химическое равновесие.
Согласно второму началу термодинамики всякая термодинамическая система стремится к такому состоянию, которое является наиболее вероятным в данных условиях по сравнению с любым другим, т.е. к равновесному состоянию.
С физической стороны равновесие системы не означает прекращения процесса, а наступает тогда, когда скорость прямой реакции Vпр. Становится равной скорости обратной реакции Vобр.: Vпр. = Vобр..
Согласно закону действующих масс для реакции
aA + bB ® cC + gG (2.10)
K равн. = 
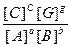 (2.11)
(2.11)
где [ A ], [B ], [ C ], [ G ] - равновесные концентрации реагирующих веществ,
a, b, c, g - стехиометрические коэффициенты,
K равн. - константа химического равновесия.
Если концентрации реагирующих веществ выражены в моль/л, то константу равновесия обозначают КС. Если концентрации реагирующих веществ (газообразных реагентов) выразить через давление, то константу равновесия обозначают КР. Между КС и КР существует взаимосвязь, выражаемая следующим соотношением:
КС = КР (RT)-Dn (2.12)
где Dn - изменение числа молей газообразных реагентов в процессе реакции. Если реакция протекает без изменения числа молей, то КС = КР. Константа химического равновесия позволяет прогнозировать направление процесса.
Если K равн.» 1, то рассматриваемый процесс протекает со значительным выходом конечных продуктов; равновесие реакции смещено вправо (®).
Если K равн. «1, то выход продуктов реакции мал, равновесие процесса смещено влево ().
Известно, что направление процесса определяют свободная энергия Гиббса DG и энергия Гельмгольца DF. Следовательно, существует взаимосвязь между величинами DG, DF и K равн., которая устанавливается уравнением изотермы Вант-Гоффа:
DG0 = - RT ln KP (p = const, T = const) (2.13)
Уравнения изотермы химических реакций позволяют рассчитать свободные энергии Гиббса или Гельмгольца, если даны константы равновесия и наоборот.
 2022-01-07
2022-01-07 197
197








