В качестве калорических параметров состояния термодинамической системы рассматриваются внутренняя энергия, энтальпия и энтропия.
Полная энергия термодинамической системы складывается из внешенй и внутренней энергий. Внешняя энергия определяется как сумма потенциальной энергии системы во внешнем поле сил (гравитационном, электрическом и др.) и кинетической энергии системы, то есть энергии ее движения относительно тел окружающей среды. Остальная часть полной энергии системы называется внутренней энергией. В общем случае внутренняя энергия системы (рабочего тела) складывается из кинетической энергии поступательного, вращательного, а также колебательного движения молекул, потенциальной энергии сил сцепления (отталкивания) между молекулами, внутримолекулярной, внутриатомной и внутриядерной энергии.
Если к рабочему телу подвести некоторое количество теплоты, результатом будет изменение внутренней энергии, Дж
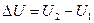 , ,
| (2.22) |
где U 1, U 2 – количество внутренней энергии рабочего тела до начала подвода к нему теплоты и после окончания подвода теплоты, Дж.
Для определения изменения внутренней энергии нет необходимости знать, по какому закону происходил подвод теплоты к телу.
Изменение удельной внутренней энергии идеального газа определяется по формуле, Дж/кг
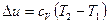 . .
| (2.23) |
Энтальпия (теплосодержание) – термодинамическая функция, имеющая смысл полной (суммы внешней и внутренней) энергии системы. Она складывается из внутренней энергии u и упругостной энергии p υ, обусловленной наличием внешнего давления окружающей среды, то есть p υ – это работа, которую надо затратить, чтобы ввести рабочее тело объемом υ в среду, имеющую давление p, Дж/кг
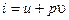 . .
| (2.24) |
Изменение удельной энтальпии идеального газа определяется по формуле, Дж/кг
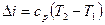 . .
| (2.25) |
У каждой термодинамической системы существует однозначная функция состояния S, изменение которой в равновесных процессах происходит только при обмене энергией в форме теплоты. Эта функция получила название энтропия. Энтропия – параметр состояния, дифференциал [бесконечно малое изменение] которого равен отношению бесконечно малого количества теплоты dQ в элементарном обратимом процессе к абсолютной температуре T, постоянной на бесконечно малом участке процесса, на котором подводится (отводится) теплота dQ, Дж/К
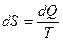 . .
| (2.26) |
Энтропию, отнесенную к единице массы тела называют удельной энтропией, Дж/(кг·К)
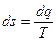 . .
| (2.27) |
С физической точки зрения энтропия – мера ценности теплоты, его работоспособности и технологической эффективности. То есть при получении изолированной системой некоторого количества теплоты, чем меньше энтропия системы, тем больше совершаемая системой работа.
С микрофизической точки зрения энтропия является количественной мерой хаотичности, неупорядоченности теплового движения. Увеличение энтропии соответствует уменьшению упорядоченности в расположении микрочастиц и в распределении энергии между ними.
Введение понятия энтропии позволяет наглядно представить термодинамический процесс в координатах T – s. Количество теплоты, участвовавшее в термодинамическом процессе при изменении рабочего тела от состояния 1 до состояния 2, можно определить следующим образом, Дж/кг
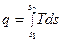 . .
| (2.28) |
В T – s –диаграмме это количество теплоты равно площади s 112 s 2 s 1, ограниченной линией процесса 1–2 и осью абсцисс (рис. 2.3). Теплота подводится, если энтропия системы увеличивается, и наоборот, если энтропия системы уменьшается, то теплота от системы отводится.
Первый закон термодинамики [1,С. 194, 209–211], [5, С. 24–25], [6, С. 34–38], [7, С. 8–11]
Первый закон термодинамики представляет собой закон сохранения и превращения энергии, в применении к закономерностям превращения теплоты в работу. Согласно закону сохранения и превращения энергии, энергия не исчезает и не возникает вновь, она лишь переходит в различных физических и химических процессах из одного вида в другой.
Формулировка первого закона термодинамики: изменение внутренней энергии термодинамической системы Δ U равно разности между сообщенным системе количеством теплоты Q и совершенной работой L
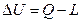 , ,
| (2.29) |
или теплота, сообщенная системе, расходуется на увеличение внутренней энергии и на совершение внешней работы
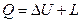 . .
| (2.30) |
Уравнение первого закона термодинамики для однородной термодеформационной системы, участвующей в элементарном термодинамическом процессе, для удельных величин примет вид
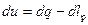 . .
| (2.31) |
Если в это уравнение подставить выражения удельных элементарных количеств теплоты и работы деформации, можно получить основное уравнение термодинамики для термомеханической системы
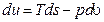 . .
| (2.32) |
Первый закон термодинамики может быть также сформулирован следующим образом: невозможно создать вечный двигатель первого рода, то есть такую циклически действующую машину, которая совершала бы работу, не заимствуя энергию извне.
Второй закон термодинамики [1,С. 194, 240–241], [6, С. 51–53], [7, С. 15–16]
Второй закон термодинамики характеризует направление, по которому протекают естественные явления в природе (направление протекания тепловых процессов).
Формулировки второго закона термодинамики:
– Р. Клаузиуса: «Теплота не может сама собой переходить от менее нагретого тела к более нагретому, то есть некомпенсированный переход теплоты от тела с меньшей температурой невозможен»;
– В. Томсона: «Невозможно получить от какого-либо тела работу, не производя никакого другого действия, кроме охлаждения этого тела», то есть не вся теплота, полученная от нагревателя, может перейти в работу, а только ее часть, другая же часть теплоты при этом должна перейти в холодильник;
– В. Оствальда: «Невозможно создать вечный двигатель второго рода», то есть периодически действующую машину, все действия которой сводились бы только производству механической работы и отъему теплоты от одного источника тепла.
Вопросы для самопроверки:
– Внутренняя энергия как параметр состояния термодинамической системы
– Энтальпия как параметр состояния термодинамической системы
– Энтропия как параметр состояния термодинамической системы
– Формулировки первого закона термодинамики
– Формулировки второго закона термодинамики
Литература
1. Лапшев, Н.Н. Основы гидравлики и теплотехники: учебник для студ. учреждений высш. проф. образования / Н.Н. Лапшев, Ю.Н. Леонтьева. – М.: Издательский центр «Академия», 2012. – 400 с. – (Сер. Бакалавриат).
2. Кричевский, И.Р. Понятие и основы термодинамики / И.Р. Кричевский. – М.: «Химия», 1970. – 440 с.
3. Теплотехника: учебник для вузов / В.Н. Луканин, М.Г. Шатров, Г.М. Камфер и др.; Под ред. В.Н. Луканина. – 3-е изд., испр. – М.: Высш. шк., 2002. – 671 с.
4. Смирнова, М.В. Теоретические основы теплотехники: учебное пособие для СПО / М.В. Смирнова. – Волгоград: ИД «Ин-Фолио», 2010. – 272 с.
5. Техническая термодинамика: учебник для вузов / Под ред. В.И.Крутова – 2-е изд., перераб. и доп. – М.: Высш. школа, 1981. – 439 с.
6. Теплотехника: учебник для втузов / А.М. Архаров, И.А. Архаров, В.Н. Афанасьев и др.; под общ. ред. А.М. Архарова, В.Н. Афанасьева. – 2-е изд., перераб. и доп. – М.: Изд-во МГТУ им. Н.Э. Баумана, 2004. – 712 с.
7. Быстрицкий, Г.Ф. Энергосиловое оборудование промышленных предприятий: учеб. пособие для студ. вузов / Г.Ф. Быстрицкий. – 4-е изд., стер. – М.: Издательский центр «Академия», 2008. – 304 с.
8. Колчин, А.И. Расчет автомобильных и тракторных двигателей: Учеб. пособие для вузов / А.И. Колчин, В.П. Демидов – 4-е изд., стереот. – М.: Высш. шк., 2008. – 496 с.
 2021-09-21
2021-09-21 377
377






