Физические свойства кристаллов определяются в основном верхними зонами, еще содержащими электроны. Энергетический интервал Eg между «дном» Ec (минимум энергии) самой верхней еще содержащей электроны зоны и «потолком» Ev (максимум энергии) предыдущей целиком заполненной зоны, называется запрещенной зоной. (
Внешнее воздействие, (повышение температуры, облучение, например светом, или сильные внешние электрические поля) могут вызвать переброс электронов через запрещенную зону. В результате появляются «свободные» носители заря (электроны проводимости и дырки), осуществляющие проводимоcть.
Ширина запрещенной зоны при данных термодинамических условиях (Т и Р) является постоянной величиной. Ей соответствует положение края полосы поглощения в длинах волн, определяемое из уравнения
C учетом принципа Ле Шателье следует ожидать, что ширина запрещенной зоны должна падать с увеличением температуры и расти с увеличением давления.
Для некоторых бинарнах полупроводников для определения ширины запрещенной зоны можно воспользоваться формулой, преложенной Бьюбом:
ΔE=C(NX-NM)/(AM+AX), где
ΔE – ширина запрещенной зоны; NX – число валентных электронов аниона; NM – число валентных электронов катиона; AM – атомный номер катиона AX - атомный номер аниона; C – эмпирически подобранная величина, равная 43.
Для определения ширины запрещенной зоны можно воспользоваться спектрами диффузного отражения. Ширину запрещенной зоны определяют по точке пересечения с осью абсцисс линии параллельной крутому подъему кривой спектра. Если частота падающего света такова, что осуществляются переходы электронов из валентной зоны в зону проводимости, то для данной области спектра будет наблюдаться большой рост поглощения (спад отражения). Собственное поглощение обусловлено переходами электронов из валентной зоны в зону проводимости с поглощением фотона. Длина волны λ и частота ν соответствуют краю собственного поглощения, приближенно определяются условиями hc/ λ=h ν=ΔE, где ΔE – оптическая ширина запрещенной зоны.
Ширину запрещенной зоны можно определить по снятой опытным путем зависимости электропроводности (удельного электрического сопротивления) от температуры, построив график зависимости lgσ=f(1/T) в области собственной электропроводности по наклону полученной кривой.
tgα= Δ tgα/ Δ(1/T)
Задача и ее решение
Определить ширину запрещенной зоны ZnTe по формуле Бьюба и по спектру диффузного отражения (Длина волны λ, соответствующая краю собственного поглощения равна 565нм).
Решение:
Определяем ширину запрещенной зоны по формуле Бьюба:
ΔE=C(NX-NM)/(AM+AX)=43·(6-2)/(30+52)=2,1(эВ);
По спектру диффузного отражения:
ΔE=hc/ λ=6.62·10-34дж·сек·3·108м·сек-1/565·10-9м=
3,515·10-19дж=2,2эВ
Ответ: ΔE=2,2эВ.
Задача 1.5. Определить ширину запрещенной зоны для различных соединений по спектрам диффузного отражения и по формуле Бьюба. Сравнить полученные значения.
Таблица 1.5. – Варианты заданий.
| Вариант | ||||||
| Соединение | ZnS | CdS | ZnSe | CdTe | ZnO | SnO |
Вопросы:
1.Назовите известные вам методы определения ширины запрещенной зоны.
2.Как зависит ширина запрещенной зоны полупроводниковых материалов от температуры и давления?
3.Как изменяется ширина запрещенной зоны в твердых растворах халькогенидов?
Высокотемпературные материалы на основе ZrO2
Теоретическая часть
Современная техника уже не может обходиться без материалов, способных одновременно и длительно выдерживать агрессивные среды, высокие температуры, вакуум и т. д. Примером могут бытьматериала на основе диоксида циркония.
К настоящему времени установлено существование пяти модификаций чистой диоксида циркония, а именно:
Аморфная модификация возникает в результате термического разложения гидроксида циркония обладает высокой реакционной способностью, в связи, с чем имеет большое практическое значение при производстве методом твердофазного синтеза различных растворов и соединений бинарных систем. При нагреве до температуры выше 800 К рентгеноаморфная модификация в отсутствие других примесей начинает кристаллизоваться, образуя моноклинную модификацию диоксида циркония. Моноклинная модификация диоксида циркония при нормальном давлении устойчива вплоть до температур порядка 1300—1500 К. При нагреве до более высоких температур данная модификация двуокиси циркония переходит в тетрагональную. Тетрагональная модификация Переход из моноклинной модификации в тетрагональную сопровождается резким изменением объема (до 9%), в результате чего происходит разрушение изделий из чистого диоксида циркония. Кубическая модификация. чистой двуокиси циркония и при нормальном давлении данная модификация может быть получена только при температурах выше 2650 К. Ромбическая модификация может быть получена из моноклинной модификации ZrO2 при сравнительно невысоких температурах (в пределах от 750К до 1300 К) и давлениях, больших 85 кбар.
Характерный для чистого диоксида циркония фазовый переход – моноклинная–тетрагональная модификация ZrO2 и связанное с этим изменение удельного объема полностью устраняется введением стабилизирующей примеси 8 мол.% СаО. Только устранение разрушительного моноклинно–тетрагонального превращения позволило использовать данный высокотемпературный материал.
Задача и ее решение
Какое массовое количество Y2O3 необходимо для приготовления 40 г шихты состава ZrO2(85)∙Y2O3(15). В скобках указаны мольные проценты.
Дано: 40 г шихты, содержание Y2O3 в шихте 15 мол.%.
Найти: Массовое количество Y2O3.
Решение:М(ZrO2)=123,22, М(Y2O3)=225,81. Х=225,81∙15∙100/(123,22∙85+225,81∙15)=24,4(г в 100 г шихты). В 40 г шихты - 9,76 г.
Ответ: 9, 76 г Y2O3.
Задача 1.6. Какое массовое количество оксидов редкоземельных металлов и оксида кальция потребуется для стабилизации диоксида циркония?
Таблица 1.6. – Варианты заданий.
| Вариант | Количество диоксида циркония, г | Формула оксида | Количество оксида, мол.% |
| Y2O3 | |||
| La2O3 | |||
| Sm2O3 | |||
| Nd2O3 | |||
| Dу2O3 | |||
| Gd2O3 |
Вопросы:
1.Что такое полиморфизм? Назовите модификации и области применения диоксида циркония.
2.Укажите на фазовой диаграмме системы диоксид циркония – оксид кальция области твердых растворов и соединений.
3.Перечислите возможные стабилизирующие добавки.
Перспективные методы синтеза оксида иттрия, активированного европием. Метод соосаждения.
Теоретическая часть
В современных средствах отображения информации, в частности, в дисплеях с полевой эмиссией электронов используют люминофоры, обладающие повышенной эффективностью при сравнительно низких ускоряющих напряжениях (менее 1кВ) и высоких плотностях тока (более 100 мкА/см2).При таких условиях глубина проникновения первичных электронов должна быть значительно меньше 1 мкм. Средний размер частиц люминофора при этом также должен быть достаточно малым, чтобы обеспечивались минимальные потери излучаемого света при проходе его через люминофорное покрытие к внешней поверхности экрана.
В качестве красного компонента люминофорного покрытия экранов полноцветных плоских панельных дисплейных устройств с низкой энергией возбуждающих электронов, в том числе дисплеев с полевой эмиссией электронов, можно использовать люминофоры на основе оксида иттрия, активированного европием и оксисульфида иттрия, активированного европием.
Для получения люминофоров на основе оксида иттрия с достаточно малым средним размером частиц в основном используют метод соосаждения оксалатов иттрия и активатора (европия) из растворов соответствующих нитратов с последующим их прокаливанием.
Задача и ее решение
Рассчитать количество оксидов иттрия и европия и объем 70% азотной кислоты (плотность кислоты 1,5 г/см3) для приготовления 100 г Y2O3·Eu.
Дано: 100г смеси оксидов; содержание Eu2O3 в смеси 3 мол.%.
Найти: массовое количество Y2O3, Eu2O3 и объем 70% HNO3, необходимый для растворения оксидов.
Решение: Находим массовые количества оксидов иттрия и европия. М(Y2O3)=225,81; М(Eu2O3)=351,92;
Решая пропорцию, находим Х – массовый.% Eu2O3
Х=351,92·3·100/(351,92·3+225,81·97)=4,6 масс.%, т.е.4,6 г в 100 г смеси. Следовательно, массовое количество Y2O3 - 95,4г. Далее составляем уравнения реакций растворения оксидов в кислоте:
Y203+6HNO3=2Y(NO3)3+3H2O
Eu2O3+6HNO3=2Eu(NO3)3+3H2O
По уравнениям реакций, зная М(HNO3)=63, находим суммарное количество азотной кислоты, далее пересчитываем количество кислоты, учитывая ее концентрацию, и находим необходимый объем кислоты, зная ее плотность.
Ответ:95,4 г Y2O3, 4,6г Eu2O3,157,8 мл HNO3.
Задача 1.7. Рассчитать необходимое количество исходных компонентов (оксида иттрия, оксида европия, 70% азотной кислоты, щавелевой кислоты) для приготовления люминофора Y2O3·Eu методом соосаждения.
Таблица 1.7. – Варианты заданий
| Вариант | Количество люминофора, г | Количество Eu2O3, вводимого в шихту, мол.% |
| 4,5 | ||
Вопросы:
1.Какие методы синтеза люминофоров на основе оксидов известны?
2.Преимущества и недостатки используемых в работе методов синтеза оксида иттрия, активированного европием
3.В каких приборах используют люминофоры с субмикронным размером частиц?
Перспективные методы синтеза оксида иттрия, активированного европием. Метод горения.
Весьма перспективным способом получения люминофоров с субмикронным размером частиц является метод синтеза оксидов в процессе горения органических азотсодержащих соединений в присутствии нитратов. Этот способ прост, так как не требует специального технологического оборудования и экологически безопасен. В качестве топлива можно использовать глицин, карбамид, карбогидразид и др.
Сущность этого метода заключается в том, что сначала в водном растворе нитратов иттрия, европия и аммония растворяют карбамид. Затем полученную смесь растворов помещают в широкий тигель из термостойкого материала, который накрывают крышкой и ставят в печь, разогретую до температуры 500-800°С. По окончании процессов кипения и дегидратации солей между нитратами и карбамидом начинается экзотермическая реакция, сопровождающаяся выделением большого количества тепла, которого достаточно для синтеза люминесцентного материала. Эта реакция протекает очень быстро (примерно в течение 5-15 секунд) и сопровождается выделением паров воды, углекислого газа и молекулярного азота. В ходе реакции на поверхности порошка становятся заметными сильно разогретые участки и локальные очаги воспламенения. Температуру, до которой в ходе реакции разогреваются взаимодействующие реагенты и которая достигает значений 1400-1600 оС, можно определить по формуле
Т=То+(ΣΔНреаг-ΣΔНпрод)/ ΣСпрод,
где То –исходная температура в печи; ΔНреаг и ΔНпрод - стандартные значения теплоты образования реагентов и конечных продуктов.
В процессе получения люминофора методом горения протекают следующие реакции: 2Y(NO3)3+5СО(NH2)2→Y2О3+5СО2+10Н2О+8N2+∆Н1
2Eu(NО3)3+5СО(NH2)2→Eu2O3+5CO2+10H2O+8N2+∆H2
3NH4NO3+СО(NH2)2→CO2+8H2O+4N2+∆H3
Из этих уравнений видно, что продуктами реакций горения являются полученный в виде твердого раствора оксидов редкоземельных элементов люминофор (Y 1-х Euх)2 О3, вода, азот и углекислый газ
Задача и ее решение
Рассчитать необходимое количество мочевины для получения методом горения 10 г люминофора Y2O3·Eu.Содержание Eu2O3 в твердом растворе – 4 мол.%.
Решение: Находим весовые количества оксидов иттрия и европия:
М(Y2O3)=225,81; М(Eu2O3)=351,92;
Решая пропорцию, находим Х – массовый.% Eu2O3
Х=351,92·4·100/(351,92·3+225,81·96)=6,1масс.%, т.е.0,61 г в 10 г твердого раствора. Следовательно, массовое количество Y2O3 - 9,39г. Далее составляем уравнения реакций горения и далее, зная М/СО(NH2)2/=60, решаем пропорции и находим необходимое для горения количество мочевины.
2Y(NO3)3+5СО(NH2)2→Y2О3+5СО2+10Н2О+8N2+∆Н1
2Eu(NО3)3+5СО(NH2)2→Eu2O3+5CO2+10H2O+8N2+∆H2
Ответ:14,99г мочевины.
Задача 1.8. Рассчитать необходимое количество мочевины для получения методом горения заданного количества Y2O3·Eu-люминофора.
Таблица 1.8. – Варианты заданий
| Вариант | Количество люминофора, г | Содержание оксида европия в твердом растворе, мол.% |
| 4, 5 | ||
Вопросы:
1.В чем заключается сущность метода горения?
2.Как определить температуру, до которой в ходе реакции разогреваются взаимодействующие агенты?
3.Какие виды топлива используют в реакциях горения?
4.Назовите области применения люминофоров с субмикронным размером частиц?
Подготовка кремниевых подложкек для интегральных схем.
Теоретическая часть
В современной технологии полупроводниковых приборов особое значение имеют методы химического воздействия на исходный кристалл кремния, которые позволяют формировать в нем разнородные области (n- и р-типа, окисленные участки поверхности и т. п.), являющиеся активными и пассивными элементами структуры. К этим методам, прежде всего, относятся отмывка и травление. Существуют различные способы травления:
1. Химическое травление, основанное на различной химической активности структурных составляющих или участков кристалла по отношению к химическим реагентам. Химическое травление может происходить как в жидкой среде — в водных и неводных растворах, в расплавах солей и металлов, так и в газовой фазе
2. Электрохимическое травление, основанное на анодном растворении материала под действием пропускаемого через систему тока.
3. Ионное травление происходит на кристалле, служащем катодом, в тлеющем разряде в вакууме.
Для травления металлов эффективны все способы. Для травления полупроводников ионная бомбардировка используется редко, так как необходимый эффект можно достигнуть другими более простыми способами. Травлению для выявления дислокации должна обязательно предшествовать химическая полировка, в процессе которой удаляется поверхностный слой и получается зеркальная поверхность, на фоне которой четко выявляется дислокационная структура монокристалла кремния. Полирование поверхности можно проводить, используя мягкий травитель состава HNO3:HF:СН3СООН =3:2:2. По внешнему виду протравленной поверхности можно сделать заключение о наличии и плотности таких дефектов структуры, как дислокация.
Задача и ее решение
Определить глубину нарушенного слоя кремниевой пластины - δ, если известны общее количество удаленного материала – ΣΔpi; диаметр образца – d; плотность кремния – γ
Дано: ΣΔpi=0,04 г; d=3см; γ =
Решение: 
глубину нарушенного слоя находим по формуле:
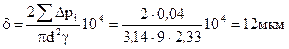
Задача1.9.Найти глубину нарушенного слоя образца кремния.
Таблица 1. 9. – Варианты заданий
| Вариант | ||||||
| ΣΔpi, г | 0,01 | 0,2 | 0,03 | 0,09 | 0,1 | 0,3 |
| d,см | 3,5 | 6,8 |
Вопросы:
1.Для чего и каким образом производят травление кремниевых пластин?
2.Назовите известные вам составы травителей кремния.
3.Как с помощью химического травления определить глубину нарушений, вызванных механической обработкой?
4.Как рассчитать плотность дислокаций?
Диффузия бора в кремний
Теоретическая часть
Диффузия примесей в монокристаллический материал является одной из основных технологических операций при создании полупроводниковых приборов. При помощи диффузии формируются области с определенным типом проводимости и градиентом концентрации в различных участках пластины полупроводникового материала, создаются диодные и транзисторные структуры, резисторы и прочие элемент интегральных схем.
При загонке бора в кремний используют В2Оз.Процесс диффузии осуществляют при температуре 10000 С в токе аргона.
В процессе загонки на поверхности кремния формируется относительно тонкий, насыщенный бором слой. Это происходит за счет конденсации испаряющегося В2Оз и обменного взаимодействия конденсата с кремнием.
Задача и ее решение
Исходный материал — кремний n-типа КЭФ — 2,0/0,5.Сопротивлению 2,0 Ом-см соответствует концентрация носителей Nд= 1,5-1016 см-3 (фоновая концентрация доноров).
Условные режимы диффузии: загонка t=1050° С, τ=20 мин (аргон); разгонка t=1200°С, τ=1,5 ч (влажный кислород). Экспериментально измеренное поверхностное сопротивление Rs после загонки равно 50 Ом. Глубину залегания р – n-перехода
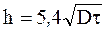 |
определяем из соотношения

При 10500С D=9∙10-14cм2/с; τ=20 мин=1200c;
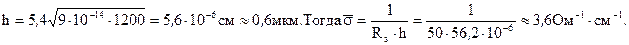
Поверхностная концентрация бора Q после загонки N0=3∙1020см-3.
Общее количество бора Q, введенное при загонке
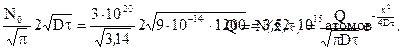
При разгонке из постоянного источника Q с отражающей границей распределения концентрации описывается формулой
 | 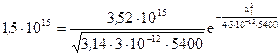 | ||
Рассчитаем глубину р—n-перехода при разгонке, т.е. расстояние xj от поверхности, при котором концентрация бора станет равной фоновой концентрации донора в исходном кремнии: Na=Nд=1,5-1015 см-3. При 1200°С D=3∙10-12см2/c. Тогда за время τ=1,5ч=5400с из соотношения
находим хj=7,7∙10-4см=7,7мкм.
Задача 1. Рассчитать общее количество бора, введенное при загонке. Известно:поверхностная концентрация бора после загонки - 2∙1019см-3, коэффициент диффузии D=6∙10-14cм2/с, время загонки 40 мин.
Задача 2. Рассчитать глубину p - n-перехода при разгонке: Na=Nд=1,5-1015 см-3. при 1200°С D=2∙10-12см2/c. за время τ=1,ч.
Вопросы:
1.Каким образом создают p –n-переход на пластине кремния?
2.Назовите основные параметры диффузионного слоя.
3.Как рассчитать глубину p–n-перехода?
4.Какие легирующие примеси используют для создания p–n-перехода?
Вопросы:
1.Для чего и каким образом производят травление кремниевых пластин?
2.Назовите известные вам составы травителей кремния.
3.Как с помощью химического травления определить глубину нарушений, вызванных механической обработкой?
4.Как рассчитать плотность дислокаций?
5.Каким образом создают p –n-переход на пластине кремния?
6.Назовите основные параметры диффузионного слоя.
7.Как рассчитать глубину p –n-перехода?
8.Назовите способы нанесения омических контактов на кремниевые пластины.
Создание омических контактов на кремнии
Теоретичекая часть
Для создания омических контактов на поверхность кремния наносят металлические покрытия: никелирование, хромирование, серебрение, золочение, напыление алюминия.
Химическое никелирование – это окислительно-восстанови-тельная реакция взаимодействия ионов никеля с восстановителем (гипофосфитом натрия NaH2PO2, гидразином N2H2, борнитридом натрия NaBH4), в результате которой на поверхности металла образуется слой никеля. Наиболее распространен химический способ никелирования с использованием гипофосфита натрия. В данном случае восстановление происходит по реакции:
Ni2++2NaH2PO2+2H2O=Ni+2NaH2PO3+H2+2H+
Состав раствора для химического никелирования: хлорид никеля, 30г/л, гипофосфит натрия 10г/л, хлорид аммония 50 г/л, лимонная кислота10г/л. Для осуществления процесса никелирования указанный раствор подогревают до температуры 950С и добавляют водный раствор аммиака до рН=8.
Состав раствора для химического никелирования: хлорид никеля30г/л, гипофосфит натрия 10г/л, хлорид аммония 50 г/л, лимонная кислота10г/л. Для осуществления процесса никелирования указанный раствор подогревают до температуры 950С и добавляют водный раствор аммиака до рН=8.
Состав раствора для химического никелирования: хлорид никеля, 30г/л, гипофосфит натрия 10г/л, хлорид аммония 50 г/л, лимонная кислота 10г/л. Для осуществления процесса никелирования указанный раствор подогревают до температуры 950С и добавляют водный раствор аммиака до рН=8.Ниже приведен примерный расчет основных параметров диффузного слоя.
Задача и ее решение
Кремниевая пластина, общая площадь поверхности, которой 25 см2, используется в качестве катода при электролизе соли никеля. Какой толщины достигает слой никеля, выделевшегося на катоде, за 5 мин, если средняя плотность тока равна 0,5А/дм2. Плотность никеля – 8,91 г/см3.
Решение. Определяем количество никеля, выделевшегося на электроде по уравнению
m=zIt/F
Для этого расчитываем эквивалентную массу никеля
z=58,7/2=29,35 г.
Определяем силу тока
I=i·S=0,5·10-2·25=0,125А
Количество выделевшегося никеля составит:
m=29,35·0,125·300/96500=0,01г
Ответ: количество никеля - 0,01г.
Задача 1.11.Определить количества различных металлов выделяющихся на кремнии при гальваническом нанесении омических контактов.
Таблица 1.11. – Варианты заданий.
| Вариант | ||||||
| Металл | Ni | Au | Au | Ni | Cr | Ag |
| Площадь пластины Si,см2 | ||||||
| Сила тока, А/дм3 | 0,5 | 0,6 | 0,4 | 1,5 | ||
| Время, мин. |
Вопросы:
1.Назовите способы нанесения омических контактов на кремниевые пластины.
2.Напишите уравнения реакций восстановления никеля из растворов с восстановителями: NaH2PO2, N2H2, NaBH4.
3.Какие процессы протекают у электродов при электролизе водного раствора хлорида никеля?
Технология изготовления светодиодов.
Теоретическая часть
Процесс изготовления светодиодов складывается из следующих основных этапов:
выращивание легированных монокристаллов в виде крупных слитков;
резка слитка на пластины, ориентированные по определенному кристаллографическому направлению; шлифовка, полировка и травление пластин;
создание р-n – перехода (легирование);
сборка светодиода.
Все стадии отличаются от традиционных для полупроводникового производства, например кремниевых приборов. Для создания p-n – перехода применяют два принципиально различающихся способа: диффузию и эпитаксиальное наращивание. Эпитаксия – это полное воспроизведение кристаллографической ориентации подложки в выращенном на ней слое вещества. В настоящее время диффузию не используют как самостоятельный метод легирования, а применяют для изготовления светодиодов только в сочетании с эпитаксиальными методами.
Арсенид галлия – технологически наиболее разработанный материал, а диоды на его основе имеют самым высокий к.п.д, однако они работают в невидимой области (900-1000 нм). ИК-излучение арсенида галлия может быть преобразовано в видимое с помощью антистоксовых люминофоров.
Антистоксовые люминофоры получают на основе фторидов, оксисульфидов, оксихлоридов и различных оксидных систем редкоземельных элементов. Оксисульфиды иттрия, гадолиния и лантана, активированные ионами Er3+, перспективны для преобразования слабого ИК излучения с длиной волны 0,8-1,0 мкм и для применения в визуализаторах слабых полей такого излучения на основе тандема антистоксовый люминофор – электронно-оптический преобразователь. В настоящее время проявлен интерес к люминофору на основе сульфида кальция, активированного двухвалентным европием, с сенсибилизатором – самарием. Этот
люминофор имеет высокую эффективность излучения и широкий диапазон в спектре возбуждения.
Задача и ее решение
Рассчитать количество компонентов шихты для приготовления 20 г антистоксового люминофора на основе CaS.
Дано: Раствор нитрата европия с содержанием Eu 3+ 50 г в литре и раствор нитрата самария с содержением Sm 3+ 100 г в литре. Необходимо приготовить шихту, содержащую карбонат кальция (СаСО3), серу, активаторы. Содержание активаторов в люминофоре должно быть следующим: 10 -3 г Eu 3+г СаS, 2·10-3г Sm 3+/1г СаS. Найти: необходимое количество карбоната кальция, серы и объемы вводимых активаторов.
Решение:Сульфид кальция образуется при взаимодействии карбоната кальция c серой по реакции: 2CaCO3+3S=2CaS+2CO2+SO2.
М(СаСО3)=100,09, М(S)=32, М(CaS)=72,14.По уравнению реакции, составляя пропорции находим количества карбоната кальция и серы, необходимые для получения 20 г сульфида кальция.
2·100,09=200,18 г/моль - 2·72.14=144,28г/моль
Х г СаСО3 - 20 г CaS
Х=(200,18·20)/144,28=27,75 г
3·32=68 г/моль - 2·72.14=144,28г/моль
У г S 20 г CaS
У=(68·20)/144,28=9,42г S.
Объемы активаторов находим, составляя пропорции:
В 1л=1000мл - 50 г Eu 3+
в х мл - 20·10 –3 г Eu 3+ х=0,4 мл;
в 1000мл - 100 г Sm 3+
в у мл - 20·2·10-3 Sm 3+ у=0, 4мл
Ответ: 27,75 г СаСО3, 9,42 г S, 0,4 мл раствора нитрата европия, 0,4мл раствора нитрата самария.
Задача 1. Рассчитать состав шихты CaS-люминофора, используя растворы активаторов с содержанием иона металла 50 г в литре по предлагаемым вариантам.
Таблица 6.1. – Варианты заданий
| Вариант | Количество люминофора, г | Содержание Eu+3 в люминофоре, г/г | Содержание Sm+3 в люминофоре, г/г |
| 10-3 | 10-3 | ||
| 3·10-3 | 10-3 | ||
| 10-3 | 10-3 | ||
| 2·10-3 | 3·10-3 | ||
| 10-3 | 5·10-4 | ||
| 2·10-5 | 6·10-5 |
Вопросы:
1. Какие люминофоры называют антистоксовыми? Приведите примеры антистоксовых люминофоров.
2. Назовите области применения антистоксовых люминофоров.
3. Объясните механизм возбуждения антистоксовой люминесценции.
4. Какое количество Eu2+ и Sm3+ содержится в люминофоре?
Практическое занятие №13
Наносистемы
Теоретическая часть
Известно, что частицы твердой фазы нанометрических размеров имеют особые механические, оптические, электрические и магнитные свойства, отличающиеся от аналогичных свойств макросистем, вследствие чего наночастицы нашли широкое применение в различных областях науки и техники.
Физико-химические свойства наночастиц отличаются от соответствующих свойств макрофазы
Разработаны различные методы получения нанодисперсных систем, позволяющие весьма тонко регулировать размеры частиц, их форму и строение. Изучение процесса зарождения и роста новой фазы показало, что в зависимости от условий кристаллизации, из раствора могут образовываться как аморфные, так и кристаллические нанодисперсные частицы разнообразной формы.
Сильное влияние на процесс кристаллизации могут оказывать ПАВ, присутствующие в растворе. В зависимости от природы и концентрации они могут изменять скорость образования и роста зародышей новой фазы, распределения наночастиц по размерам, а также форму кристаллов. Все эти факторы связаны с избирательной адсорбцией молекул или ионов ПАВ на различных гранях образующихся кристаллов и как следствие, с замедлением роста одних граней по сравнению с другими. Кроме того, природа ПАВ оказывает сильное действие и на полиморфизм образующихся соединений.
С экологической точки зрения оптимальными являются бессточные методы получения композиционных материалов, в частности, золь-гель. Этот метод позволяет исключить многочисленные стадии промывки, так как в качестве исходных веществ используют соединения, не вносящие примеси в состав конечного продукта. Этот метод основан на реакциях полимеризации неорганических соединений. Золь-гель метод обеспечивает однородность продукта на молекулярном уровне и его высокую чистоту, при этом можно управлять структурой конечного продукта еще на стадии образования гелей.
Частицы с малым размером могут быть выделены из суспензии методом отмучивания. Метод отмучивания основан на многократном сливании суспензии от первоначального уровня Н до некоторого уровня h по прошествии принятого вначале промежутка времени τ от начала седиментации. Фигуровский предложил расчет необходимого числа отмучиваний. Ниже приводится пример расчета.
Задача и ее решение
Дано: Число частиц размерами δ=0,9δа осталось в грубой фракции не более 2% от имевшихся в исходном материале, т.е. не более 0,02Q;h=08H.
Найти:число отмучиваний n.
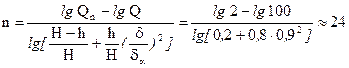 |
Решение: Число отмучиваний находим, используя формулы Краснова и Фигуровского.
По формуле Краснова находим число отмучиваний:
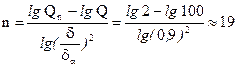 |
По формуле Фигуровского:
Ответ: n=24(по формуле Краснова), n=19(по формуле Фигуровского).
Задача 1.13. Найти число отмучиваний для суспензий различного состава.
Таблица 1.13.-Варианты заданий.
| Вариант | Размеры частиц | Число частиц в грубой фракции,% | Уровень высоты |
| δ=0,9δa | 1,4 | 0,70 | |
| δ=0,85a | 2,0 | 0,80 | |
| δ=0,95δa | 1,5 | 0,75 | |
| δ=0,9δa | 2,5 | 0,90 | |
| δ=0,9δa | 2,0 | 0,85 | |
| δ=0,75δa | 1,8 | 0,80 | |
| δ=0,9δa | 2,0 | 1,50 | |
| δ=0,9δa | 1,5 | 0,70 |
Вопросы:
1.Что называют наносистемами? В чем их отличие от макросистем?
2.Назовите известные методы получения наночастиц.
3.Как можно разделить по геометрическому признаку коллоидные наносистемы?
4.Назовите преимущества и недостатки золь-гель метода.
Практическое занятие №14
Определение размеров микрочастиц
Теоретическая часть
Для определения гранулометрического состава полидисперсных порошков могут быть применены различные способы: седиментационный, микроскопический, по определению насыпной массы, адсорбционный, а также разные варианты электрических методов.
Седиментационный метод основан на наблюдении скорости оседания порошка из суспензии. Суть метода заключается в том, через определенные промежутки времени определяют массу осевшего порошка. По полученной на основании экспериментальных данных кривой рассчитывают содержание фракций, осевших к заданному времени. Линейные размеры частиц вычисляют в соответствии с законом Стокса.
Рассмотрим работу микронного фотоизмерителя. В основе его работы лежит явление ослабления света суспензий твердых частиц в жидкости, оседающих по закону Стокса. Чтобы ускорить процесс оседания мелких частиц в измерителях используется центрифуга.
Задача и ее решение
Рассчитать средний размер частиц порошка оксида цинка при заданных условиях оседания его в пирофосфате натрия при температуру 200C.
Дано:η=1,003 – вязкость пирофосфата натря; γ1=5,6г/см3 – плотность оксида цинка; γ2=0,998г/см3 h=30см; t=20час.
Решение: Средний размер частиц находим по формуле в соответствии с законом Стокса:
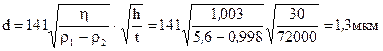
Задача1.1.Рассчитать средний размер частиц различных веществ различных условиях их оседания в растворе пирофосфата натрия.
Таблица 1.1. – Варианты заданий.
| Вариант | ||||||
| Вещество | ZnS | CdS | Y2O3 | SnO2 | ZnO | ZrO2 |
| Высота, см | ||||||
| Время,час. |
Вопросы:
1.Назовите методы определения гранулометрического состава порошков.
2.В чем сущность седиментационного метода анализа?
3.Сформулируйте закон Стокса.
4.Какие растворы используют для приготовления суспензий в седиментационном методе анализа?
Практическое занятие №15
Расчет энергии кристаллической решетки по уравнениям Борна
Теоретическая часть
Энергия кристаллической решетки – энергия, необходимая для превращения кристалла в ионный пар (Скорчеллетти). Энергия кристаллической решетки – энергия, требуемая для разложения кристалла на газообразные ионы, бесконечно удаленные друг от друга (Мелвин – Хьюз). Иногда в электрохимической литературе, чтобы подчеркнуть отсутствие взаимодействия ионов в паре, конечное состояние «ионный газ» более предпочтителен. Энергию кристаллической решетки принято обозначать через U.
Энергия кристаллической решетки – это изменение энергии Гиббса, или работа: U= ΔG =-A.
 | 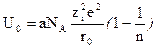 | ||
Величина энергии кристаллической решетки совпадает со значением теплового эффекта (разрушения) кристаллической решетки только при 0К, так как согласно уравнению Гиббса – Гельмгольца ΔG=ΔH - T ΔS, а изменение энтропии при превращении кристалла в ионный газ всегда отлично от нуля.

Для теоретического расчета энергии кристаллической решетки используют уравнение Борна:
где e – заряд электрона;z – заряд иона;NA – число Авогадро; индекс «о» означает работу перевода ионов из кристалла, когда они находятся друг от друга на расстоянии r0, соответствующем равновесному, в состояние ионного пара; величина «а» характеризует тип кристаллической структуры и носит название постоянной Маделунга; n – показатель степени при r в члене, характеризующем энергию отталкивания.
Задача и ее решение
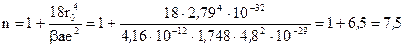 |
Рассчитать энергию кристаллической решетки NaCl по уравнению Борна, если известно, что а=1,748; β=4,16·10-12см2/дин. Величины крислаллохимических радиусов взять из «Краткого справочника физико-химических величин».
Решение
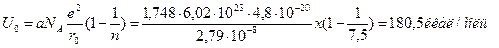 |
(В вычислениях по шкале Гольдшмидта)
Задача 1.15. Вычислить энергию кристаллической решетки указанной
соли по 1 уравнению Борна.
Таблица 8.1.-Варианты заданий.
| Вариант | Соль | β·1012, см2/дин |
| LiF | 1,53 | |
| LiCl | 3,48 | |
| NaBr | 5,09 | |
| KI | 8,54 | |
| RbCl | 7,4 | |
| RbI | 9,58 |
Вопросы:
1.С какой термодинамической функцией отождествляют величину энергии кристаллической решетки?
2.От каких факторов зависит величина постоянной Маделунга?
3.Какую из термодинамических величин позволяют рассчитать уравнения Борна и Капустинского?
4.Совпадают ли величины энергии кристаллической решетки и теплового эффекта между собой?
Практическое занятие №16
Расчет энергии кристаллической решетки по уравнениям
Капустинского
Теоретическая часть
Расчет энергии кристаллической решетки по уравнению Борна целесообразен, если известны тип решетки и расстояние r0, найденное экспериментально, например, рентгенографически. Для целей же предвидения величин U про неизвестных структуре и r0 можно использовать другой путь – расчет по уравнениям Капустинского:
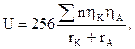
где Σn – число ионов в химической формуле кристалла; ηК и ηА - заряды катиона и аниона;rK и rA – ионные радиусы по Гольдшмидту.
Это уравнение нашло широкое применение.
Задача и ее решение 
Рассчитать энергию кристаллической решетки хлорида натрия по уравнению Капустинского.
В справочнике находим значения ионных радиусов натря и хлора. rК+rА=0, 98+1,81=2,79Å и U=2·1070,9/2,79=766кДж./моль
Ответ: U=766кДж/моль
Задача 1.16.Рассчитать энергию кристаллической решетки различных соединений, используя формулу Капустинского.
Таблица 1.16. – Варианты заданий.
| Вариант | ||||||
| Соединение | ZnS | ZnSe | CdS | ZrO2 | KCl | LiF |
Вопросы:
1.Что означает термин «энергия кристаллической решетки»?
2.В каких случаях энергию кристаллической решетки рассчитывают по уравнениям Капустинского?
3.Какой фактор учитывает второе уравнение Капустинского?
4.Как связан тип ионной решетки с отношением ионных радиусов?
Практическое занятие №17
Методы концентрирования примесей и определения чистоты полупроводников
Теоретическая часть
Получение и очистка веществ до особо чистого состояния неразрывно связано с методами анализа на микропримеси. Среди многих способов повышения чувствительности аналитических методов первостепенное значение имеет концентрирование примеси, т.е. предварительное повышение ее концентрации различными методами. К этим медодам относятся: экстракция, соосаждение, отгонка, выпаривание. Помимо этих методов на практике применяют и другие методы: ионный обмен, и хроматография, электролиз и электродиализ, образование амальгам, цементация и др. Все методы количественного анализа химических примесей можно классифицировать на 1)химические, 2)физико-химические и физические.
Из многочисленных физико-химических методов определения микропримесей остановимся на фотометрических методах. Эти методы включают колориметрию и спектрофотометрию, которые основаны на измерении количествасвета, поглощенного окрашенным раствором, а также нефелометрию – метод измерения рассеянными частицами света суспензии Из основного закона колориметрии Бугера – Ламберта - Бера вытекает, что минимальная концентрация, которую можно определить колориметрически равна c=E/εκ (1),где с – концентрация,моль/л;E – экстинкция или оптичеcкая плотность раствора; ε – молярный коэффициент поглощения, κ – толщина слоя, см.
Задача и ее решение
Определить концентрацию примеси кобальта в германии, если оптическая плотность раствора 0,01, толщина слоя 10 см, молярный коэффициент светопоглощения – 50000.Содержание германия 1г/л.
Решение: Подставляя в уравнение1 данные значения получим
с=0,01/50000·10=2·10-8 моль/л или 2·10-8 моль/г Ge/
Задача 1.17.Определить содержание примесей тяжелых металлов в кремнии. Содержание кремния в растворе – 1г/л.
Таблица 1.17. – Варианты заданий.
| Вариант | ||||||
| Примесь | Cu | Fe | Ni | V | Mn | Co |
| E | 0,03 | 0,025 | 0,04 | 0,01 | 0,03 | 0,02 |
| κ, см | ||||||
| ε |
Вопросы:
1 Как по чистоте классифицируют полупроводниковые материалы?
2.Какие примеси могут присутствовать в германии и кремнии?
3.Назовите методы конденсирования примесей?
1. Основная литература
Горелик С.С., Дашевский М.Я. Материаловедение полупроводников и диэлектриков: Учебник для вузов. – М.: МИСИС, 2006. – 480 с
Физические методы исследования материалов твердотельной электроники: Учебное пособие / Под ред. Б.М. Синельникова – Ставрополь: СевКавГТУ, 2002. – 112 с.
Таиров Ю.М., Цветков В.Ф. Технология полупроводниковых и диэлектрических материалов: Учебник для вузов. – М.: Высшая школа, 1900. – 424 с.
2.Дополнительная литература
1. Ормонт Б.Ф. Введение в физическую химию и кристаллохимию полупроводников: Учебное пособие для студентов технических вузов.– М.: Высшая школа, 1982. – 528 с.
2. Кузьмина И.П., Никитенко В.А. Окись цинка. Получение оптические свойства. М.: Наука, 1984. – 166 с.
3. Гурвич А.М Введение в физическую химию кристаллофосфоров. М.: Высшая школа, 1982.-376 с.
4. Синельников Б.М. Физика и технология люминофоров. Часть 1. Физика процессов люминесценции: Учебное пособие. Ставрополь, 2004.-103с.
 2014-02-13
2014-02-13 1369
1369
