Пусть в электрохимической системе обратимо и изотермически протекает реакция:
nAA + nBB +... ± nF Û nLL + nMM +... ± 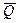
Электрическая энергия, вырабатываемая элементом, равна полезной работе А¢ суммарного процесса. Полезная работа А¢ обратимого процесса максимальна и при Р,Т = const равна убыли изобарного потенциала системы:
-DGP,T = nFEP,T
EP,T - обратимая ЭДС системы.
EP,T = -DGP,T / nF, EV,T = -DFV,T / nF
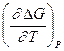 = -DS = -nF
= -DS = -nF 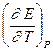
Т.о., измерив ЭДС элемента и ее температурный коэффициент, можно найти величины DG и DS для суммарного процесса, протекающего в гальваническом элементе. Этот процесс является самопроизвольным, следовательно, DG < 0.
По уравнению Гиббса-Гельмгольца можно вычислить изменение энтальпии процесса:
DG = DH + T 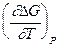
DH = DG - T 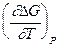 = -nFEP + TnF
= -nFEP + TnF 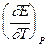
nFEP = -DH + nFT 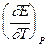 =
= 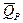 + nFT
+ nFT 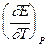
nFEV = -DU + nFT 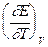 =
= 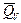 + nFT
+ nFT 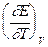
Из уравнений следует, что соотношение между электрической энергией, обратимо генерируемой или поглощаемой в электрохимической системе, и тепловым эффектом протекающей в ней реакции зависит от знака и величины температурного коэффициента ЭДС dE/dT:
1. Если dE/dT > 0, то nFE > 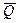 (DG > DH) и система будет превращать в электрическую энергию не только то количество теплоты, которое соответствует тепловому эффекту реакции, но и дополнительную теплоту - теплоту Пелетье QП = nFT dE/dT, заимствуемую из окружающей среды. В адиабатических условиях (в условиях тепловой изоляции, когда обмен с окружающей средой невозможен) Т системы понижается. Особенно заметно охлаждение системы, если при dE/dT > 0
(DG > DH) и система будет превращать в электрическую энергию не только то количество теплоты, которое соответствует тепловому эффекту реакции, но и дополнительную теплоту - теплоту Пелетье QП = nFT dE/dT, заимствуемую из окружающей среды. В адиабатических условиях (в условиях тепловой изоляции, когда обмен с окружающей средой невозможен) Т системы понижается. Особенно заметно охлаждение системы, если при dE/dT > 0 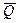 < 0 (реакция эндотермична).
< 0 (реакция эндотермична).
2. Если dE/dT < 0, то nFE < 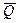 (DG < DH) и часть теплоты реакции будет рассеиваться в виде теплоты Пелетье. В адиабатическом режиме система будет нагреваться.
(DG < DH) и часть теплоты реакции будет рассеиваться в виде теплоты Пелетье. В адиабатическом режиме система будет нагреваться.
3. Если dE/dT = 0, то DG = DH и nFE = 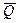 - произведенная обратимо системой электрическая энергия эквивалентна тепловому эффекту химической реакции. Это соотношение известно как принцип (правило) Томсона.
- произведенная обратимо системой электрическая энергия эквивалентна тепловому эффекту химической реакции. Это соотношение известно как принцип (правило) Томсона.
Для расчета ЭДС уравнения можно переписать в виде:
EV =  + T
+ T 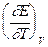
EP = 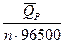 + T
+ T 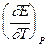
При использовании уравнений необходимо помнить, что они справедливы только для обратимых электрохимических систем, поэтому при изучении зависимости ЭДС от Т необходимо избегать применения электрохимических систем с жидкостными границами, т.к. возникающие на них диффузионные потенциалы не являются равновесными.
Свяжем ЭДС элемента с константой равновесия реакции, протекающей в элементе. Уравнение изотермы химической реакции:
-DG = RT ln K a - RT 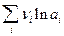
E = - 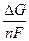 =
= 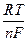 ln K a -
ln K a - 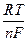
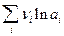
Первый член правой части уравнения при заданных Р,Т - величина постоянная, его можно обозначить через Ео. Ео - стандартная ЭДС элемента (электрохимической системы), т.е. ЭДС при всех ai = 0.
Е = Ео + 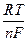 ln
ln 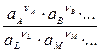 = Eo + 2,303
= Eo + 2,303 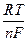 lg
lg 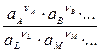
Т.о., ЭДС электрохимической системы является функцией активностей участников электрохимической реакции. Вышеприведенные уравнения дают возможность вычислить величины DG и К а по экспериментальным значениям Е и, наоборот, рассчитывать Е, зная термодинамические характеристики химической реакции.
 2014-02-13
2014-02-13 2809
2809
