КЛАССИФИКАЦИЯ ЭЛЕКТРОДОВ.
Если на электроде протекает частная реакция
nA A +... + nF = nL L +...
то потенциал электрода определяется уравнением:
j = jо + 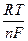 ln
ln 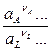
т.е. при заданных Т и Р определяется (кроме jо, который является константой) активностями веществ, участвующих в электродной реакции. Характер влияния активностей компонентов раствора на значение j связан с природой электродной реакции и лежит в основе классификации электродов. Принято различать электроды первого рода, второго рода, газовые, окислительно-восстановительные и некоторые специальные типы электродов.
ЭЛЕКТРОДЫ ПЕРВОГО РОДА.
Электроды первого рода можно схематически представить в виде Мn+ êМ (если электрод - металл) или в виде Меn- êМе (если электрод - металлоид). Электродную реакцию записывают как
Mn+ + n e ® M или Me + n e ® Men-
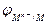 =
= 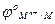 +
+ 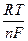 ln
ln 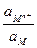 =
= 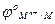 + 2,303
+ 2,303 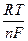 lg
lg 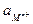
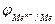 =
= 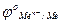 +
+ 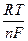 ln
ln 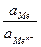 =
= 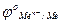 - 2,303
- 2,303 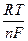 lg
lg 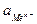
(т.к. активность чистого твердого вещества при заданной Т постоянна и можно принять ее условно равной 1).
Из уравнений следует, что потенциал электрода первого рода зависит от активности лишь одного вида ионов; эти ионы называются потенциалоопределяющими. В случае металлических электродов первого рода такими ионами являются катионы металла, а в случае металлоидных электродов - анионы металлоида. Примеры металлических электродов: металл, погруженный в раствор своей соли (Ag в растворе AgNO3 - Ag+ êAg; Cu в растворе CuSO4 - Cu2+ êCu). Пример металлоидных электродов первого рода - селеновый электрод Se2- êSe.
Металлические электроды первого рода имеют большое практическое значение и легче реализуются, чем металлоидные.
Электроды второго рода представляют собой полуэлементы, состоящие из металла, покрытого слоем его труднорастворимого соединения (соли, оксида, гидроксида) и погруженного в раствор, содержащий тот же анион, что и труднорастворимое соединение электродного металла. Схематически электрод второго рода можно представить как An- êMA êM, а протекающую в нем реакцию
MA + n e = M + An-
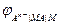 =
= 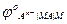 + 2,303
+ 2,303 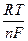 lg
lg 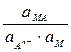 =
= 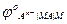 - 2,303
- 2,303 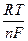 lg
lg 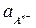
(учитывая, что активности металла и твердого соединения МА постоянны).
Т.о., потенциал электрода второго рода определяется активностью анионов труднорастворимого соединения электродного металла. Однако электроды второго рода обратимы и по отношению к катионам электродного металла:
ПРМА = 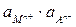
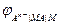 =
= 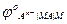 - 2,303
- 2,303 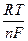 lg ПРМА + 2,303
lg ПРМА + 2,303 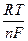 lg
lg 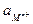 =
=
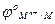 + 2,303
+ 2,303 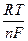 lg
lg 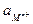 =
= 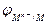
Из сопоставления потенциалов соответствующих электродов первого и второго рода можно найти ПР труднорастворимых солей.
Потенциалы электродов второго рода легко воспроизводимы и устойчивы, поэтому эти электроды часто применяют в качестве электродов сравнения, по отношению к которым измеряют потенциалы других электродов. Наиболее важны в практическом отношении каломельные, ртутно-сульфатные, хлорсеребряные, ртутнооксидные и сурьмяные электроды.
КАЛОМЕЛЬНЫЙ ЭЛЕКТРОД. Это ртуть, покрытая пастой из смеси каломели со ртутью, находящаяся в контакте с раствором KCl:
Cl- êHg2Cl2 êHg
Электродная реакция: Hg2Cl2 + 2 e = Hg + 2 Cl-
jкал = jокал - 2,303 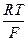 lg
lg 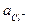
При 25оС jкал = + 0,2678 - 0,059 lg 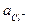
jкал определяется активностью ионов Cl-. Наиболее часто употребляются каломельные полуэлементы, в которых концентрация KCl - насыщенный раствор, 1.0 М или 0.1 М. Каломельные электроды, особенно насыщенный, удобны тем, что диффузионный потенциал, возникающий на границе данного раствора с насыщенным KCl, незначителен и во многих случаях его можно не принимать во внимание.
РТУТНО-СУЛЬФАТНЫЙ ЭЛЕКТРОД SO42- êHg2SO4 êHg аналогичен каломельному, ртуть покрыта слоем пасты из ртути и сульфата ртути (I), а в качестве раствора используется H2SO4. При 25оС:
jрт.с. = + 0,6156 - 0,0296 lg 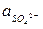
ХЛОРСЕРЕБРЯНЫЙ ЭЛЕКТРОД представляет собой систему
Cl- êAgCl êAg
jхс = jохс - 2,303 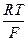 lg
lg 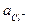 = + 0,2224 - 0,059 lg
= + 0,2224 - 0,059 lg 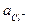
Ртутно-сульфатный и хлорсеребряный электроды целесообразно применять в тех случаях, когда исследуемый полуэлемент содержит в качестве электролита либо серную кислоту или сульфаты, либо соляную кислоту или хлориды. Чтобы уменьшить величину диффузионного потенциала, концентрацию этих электролитов в электродах сравнения следует брать такую же, как и в исследуемых полуэлементах.
МЕТАЛЛОКСИДНЫЕ ЭЛЕКТРОДЫ интересны тем, что здесь в роли анионов труднорастворимого соединения электродного металла выступают ионы гидроксида. К ним относятся, например, ртутнооксидный и сурьмяный электроды:
OH- êHgO êHg и OH- êSb2O3 êSb
Уравнения электродных реакций и потенциалов этих электродов:
HgO + H2O + 2 e = Hg + 2OH- jрт.окс. = jорт.окс. - 2,303 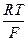 lg
lg 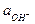
Sb2O3 + 3H2O + 6 e = 2Sb + 6OH- jсурьм. = jосурьм. - 2,303 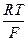 lg
lg 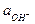
Уравнения для электродного потенциала получены при допущении, что постоянны активности не только соответствующих металлов и их оксидов, но и воды, также принимающей участие в электродной реакции.
Металлоксидные электрода второго рода, как и металлсолевые электроды второго рода, обратимы по отношению не только к ионам гидроксила, но и к ионам электродного металла. Кроме того, они обратимы и по отношению к ионам водорода, потому что ионное произведение воды при заданной Т постоянно для любого водного раствора электролита.
Металлоксидные электроды можно применять как электроды сравнения в любых растворах кислот и щелочей, однако ртутнооксидный электрод вследствие заметной растворимости оксидов ртути в кислотах можно рекомендовать лишь для растворов с рН > 7. Сурьмяный электрод из-за неустойчивости состава его поверхностного оксида применять как электрод сравнения нельзя; он используется в качестве индикаторного электрода для приближенных определений рН в умеренно кислых и нейтральных растворах.
 2014-02-13
2014-02-13 2850
2850








