Ионоселективные электроды (ИСЭ) – это датчики, позволяющие избирательно определять активность одних ионов в присутствии других.
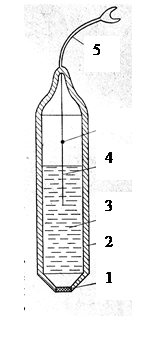
ИСЭ состоят из следующих элементов (рис. 18):
§ полупроницаемой мембраны 1 (одни ионы из раствора проходят в неё, другие – нет);
§ внутреннего раствора 3 с постоянной концентрацией определяемого иона;
§ внутреннего электрода сравнения 4;
§ а также корпуса 2 и экрпанированного провода.
Ионы могут переходить из раствора в мембрану за счёт различных процессов:
§  ионного обмена, например, в случае стеклянного, нитрат-селективного и многих др. электродов;
ионного обмена, например, в случае стеклянного, нитрат-селективного и многих др. электродов;
§ комплексообразования;
§ распределения;
§ растворимости определяемого вещества в материале мембраны;
§ ситового эффекта, если размер иона практически равен размеру пор мембраны.
Типы мембран ИСЭ.
1. Стеклянные мембраны (известны с 1906 г.) изготавливаются из специальных сортов стёкол, способных к обмену ионов.
2.
|
3. Твёрдые гетерогенные мембраны изготавливаются из твёрдого вещества, обеспечивающего ионный обмен (ионообменная смола, малорастворимое соединение, хелатный комплекс), и непроводящей матрицы (каучук, полиэтилен, полистирол):
Твёрдый ионит + Непроводящая матрица
4. Жидкие мембраны (известны с 1967 г.) изготавливаются из жидкого вещества, обеспечивающего ионный обмен, полимерного связующего (поливинилхлорид – ПВХ) и пластификатора (эфиры фталевой, себационовой и других кислот):
Жидкий ионит + Полимерное связующее + Пластификатор
Потенциал ионоселективного электрода в отсутствие
посторонних ионов
Если ИСЭ погрузить в раствор, содержащий определяемые ионы А, то на внешней и внутренней поверхности мембраны будет происходить обмен ионами А:
А(м) «А(р).
Если активности иона А во внешнем и внутреннем растворах не равны (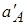 ¹
¹ 
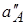 ), то возникает разность потенциалов:
), то возникает разность потенциалов:
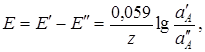
где 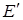 и
и 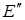 – граничные потенциалы на внешней и внутренней поверхностях мембраны. Устанавливаются за счёт неравномерного распределения носителей электричества (ионов).
– граничные потенциалы на внешней и внутренней поверхностях мембраны. Устанавливаются за счёт неравномерного распределения носителей электричества (ионов).
Поскольку 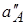 = const, то уравнение принимает вид:
= const, то уравнение принимает вид:
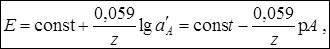 (1)
(1)
где const – постоянная величина, которая объединяет все величины, не зависящие от 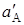 ;
;
p A = –lg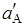 .
.
Графический вид зависимости потенциала ИСЭ от p A приведен на рис. 19.
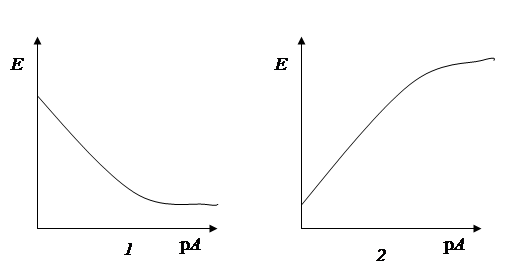
Рис. 19. Зависимость потенциала ИСЭ от pA: 1 – для катионов (z – положительная величина); 2 – для анионов (z – отрицательная величина).
Потенциал ионоселективного электрода в присутствии
мешающих ионов
Если ИСЭ погрузить в раствор, содержащий определяемые ионы А и мешающие ионы В, то на внешней и внутренней поверхности мембраны будет происходить обмен ионами А (основная реакция):
А (м) «А (р).
Помимо основной реакции в той или иной мере может протекать побочная реакция:
А (м) + В (р) «А (р) + В (м),
за счёт которой мешающие ионы В проникают в мембрану. В этом случае потенциал ИСЭ описывается уравнением Никольского (модифицированное уравнение Нернста):
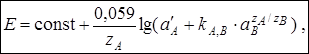 (2)
(2)
где kA,B – потенциометрический коэффициент селективности ИСЭ по отношению к иону А в присутствии мешающего иона В;
zА и zВ – заряды ионов А и В.
 2014-02-13
2014-02-13 9077
9077








