Таблица 109 – Дифференциальная диагностика оспы овец
Таблица 108 – Результаты гистологических исследований кожи свиньи, больной оспой
Индикация и идентификация вируса
Вирусоскопия. Свежую папулу протирают ватой, смоченной спиртом, срезают (лучше бритвой) и поверхностью среза делают несколько тонких мазков на предметных стеклах. Мазки подсушивают на воздухе и окрашивают методом серебрения (по Морозову). При вирусоскопических исследованиях пораженных участков кожи обнаруживают характерное расположение вирионов в виде россыпи. Однако отсутствие вирусных частиц в препарате еще не исключает оспу.
ЭМ. ЭМ пораженных участков кожи больных оспой поросят и обнаружение характерных вирусных частиц - один из методов экспресс-диагностики оспы. Для этого требуется всего около 30 мин.
Обнаружение специфических телец-включений. Развитие оспенных поражений в коже больных хорошо прослежено гистологическими исследованиями, результаты которых приведены в табл.108.
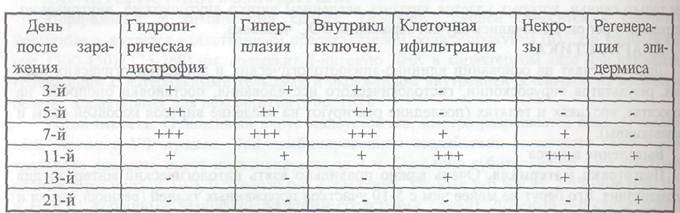
Обозначения: (+, ++, +++) - выраженность реакции
|
|
|
(-) - отсутствие реакции или внутриклеточных включений
Диагноз на оспу считают положительным при наличии в гистологических препаратах ацидофильных включений и внутриядерных вакуолей в гиперплазированных кератиноцитах эпидермиса кожи. Цитоплазматические включения при ОС относятся к группе Б, т. е. к включениям, материал которых участвует в репродукции вируса.
Серологическая идентификация. Не разработана. Однако при необходимости возможна постановка РДП и более чувствительного теста - противоточного электрофореза.
Дифференциальная диагностика. Болезнь у свиней могут вызвать вирусы ОС, оспы коров, осповакцины и, по данным некоторых исследователей, оспы кур. Дифференциацию возбудителя, вызвавшего оспу у свиней, проводят на КЭ, культурах клеток органов и тканей кроликов или поросятах. Для этого используют 2-х поросят, переболевших оспой (подопытные), и 2-х здоровых (контрольные). Им втирают в скарифицированную кожу по 2 капли растворенной сухой осповакцины. Развитие оспенных поражений у подопытных и контрольных животных через 5-8 дн после нанесения вируса осповакцины указывает на наличие в хозяйстве оспы, вызванной натуральным ВОС. Отсутствие их у подопытных животных при положительной поствакцинальной реакции у контрольных свидетельствует о наличии у свиней оспы коров или осповакцины.
Дифференциацию возбудителей, выделенных от больных свиней с клинической картиной оспы, проводят на основании данных, приведенных в табл. 109. Более простым способом дифференцирования этих болезней является заражение кролика путем введения исследуемого материала в скарифицированную кожу. ВОС не вызывает у этих животных кожной реакции, в то время как вирусы осповакцины и оспы коров ее вызывают. Оба последних вируса можно выделить также путем заражения КЭ и культур клеток. Наличие телец-включений вдоль центральной "просветленной" околоядерной зоны в пораженных эпителиальных клетках является патогномоничным для ВОС.
|
|
|
Оспу у свиней следует дифференцировать от экзантем, появляющихся при авитаминозах, аллергии и нарушении обмена веществ, энзоотической бронхопневмонии, стрептококковом сепсисе, паратифе, чесотке, лишае, ВБС и везикулярной экзантеме. При экзантемах незаразной этиологии обычно не бывает лихорадки и биопроба отрицательная. Экзантема при чесотке, паратифе и других болезнях протекает без стадийного развития, как при оспе, а из патологического материала выделяют соответствующих возбудителей.
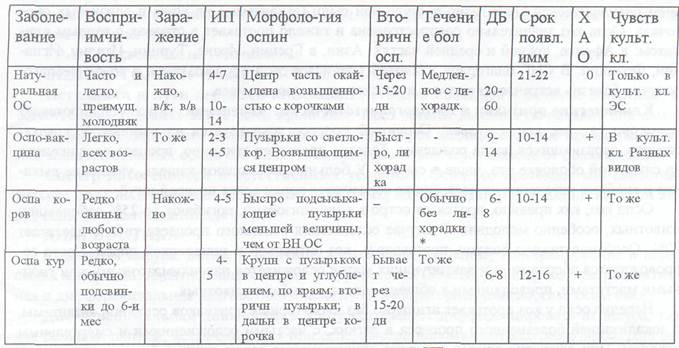
Обозначения: + наличие репродукции на ХАО; 0 - отсутствие таковой. ИН - инкубационный период; * - при отсутствии осложнений; ДБ - длительность болезни; в/к - внутрикожное заражение; в/в - внутривенное заражение.
Примечание. Свиньи оспой от овец и коз обычно не заражаются. Среди указанных вирусов перекрестный иммунитет образуется только между вирусами оспы коров и осповакцины; ВН ОС - вирус натуральной оспы свиней.
Инфекционная катаральная лихорадка овец ("синий язык" КЛО) - вирусная трансмиссивная инфекция, передающаяся кровососущими насекомыми из рода Сulicoides, характеризующаяся лихорадочным состоянием, воспалительно-некротическими поражениями ротовой полости, особенно языка, пищеварительного тракта, эпителия венчика и основы кожи копыт, а также дегенеративными изменениями скелетных мышц. Регистрируется во многих странах. В Российской Федерации с 1993 г. неблагополучными являются некоторые районы Бурятии.
Диагноз ставят на основании эпизоотологических данных, симптомов болезни, патоморфологических изменений и результатов лабораторных исследований. Для окончательного диагноза проводят выделение вируса, его идентификацию и ставят биопробу. Для выделения вируса более чувствительны 10-11-дн КЭ, заражаемые на ХАО или внутривенно пробами испытуемой крови, обработанной ультразвуком. Выделенный вирус идентифицируют в РН, применяя типоспецифические сыворотки. Для быстрого обнаружения вируса рекомендуется ИФ в культуре клеток. Показано, что РН по бляшкам более чувствительна, чем РСК и РДП. С помощью РСК удается выявлять АТ в сыворотке крови овец и КРС.
Для выделения вируса КЛО проводят иммобилизацию Сulicoides триэтиламином, которым пропитывают специальные аппликаторы. Через 2-3 мин после воздействия паров препарата обездвиженных насекомых микроскопируют и отбирают самок, которых замораживают в жидком азоте. Перед началом проведения вирусологического исследования насекомых размораживают и помещают в среду Игла МЕМ с 10% фетальной сыворотки и антибиотиками, обрабатывают ультразвуком; суспензию осветляют центрифугированием. Для выделения вируса КЛО используют перевиваемую линию клеток С 6/36, полученную из личинки Аedes оlbapietus. Эта линия высоко чувствительна, пригодна для первичной изоляции вируса КЛО из патологического материала. Линию клеток выращивают при температуре 28°С, создавая оптимальные условия для функционирования РНК-полимеразы вируса. Поскольку в этих условиях ЦПД не проявляется, то его наличие в зараженной суспензии клеток насекомых определяют с помощью ИФ и ИФА. Разработан укороченный метод первичной обработки патологического материла (пулов насекомых). Исследование его в культуре клеток показало высокую чувствительность и пригодность для полевых обследований популяций насекомых на инфицированность вирусом КЛО.
|
|
|
Установлена высокая чувствительность метода выделения вируса в перевиваемой линии культуры клеток ПСКГ в сочетании с методом ИФА. Последний рекомендован для выявления АГ вируса блутанга в инфицированных культурах клеток и в суспензии инфицированных комаров Сulicoides variipennis. Высокая чувствительность ИФА позволяет обнаружить одного инфицированного мокреца в смеси с 92 неинфицированными насекомыми. Разработан непрямой вариант ИФА для серологической диагностики блутанга. Окончательная диагностика КЛО, которая часто протекает субклинически у домашних и диких животных, может быть проведена только лабораторными методами выделения вируса, выявления АГ, нуклеиновых кислот вируса и АТ. Вирус выделяют из компонентов крови, в основном из эритроцитов, отобранных у животных во время лихорадочной реакции. Исследуемый материал вводят в КЭ и проводят пассаж в культуре клеток (ВНК -21, Vero).
Для идентификации вирусных АГ используют ИФ, РН, ИЭМ с применением монАТ и ИФА. Дня выявления нуклеиновых кислот делают гибридизационный анализ и ПЦР. АТ обнаруживают в РДП в агарозе и в конкурентном ИФА. Последняя реакция с использованием вирусепецифических монАТ является более чувствительным и специфичным методом обнаружения АТ к КЛО. РН в культуре клеток служит наиболее общепринятым методом выявления типоспецифических АТ. Во ВНИИЗЖ также получены монАТ для постановки ингибирования ТФ ИФА.
КЛО необходимо дифференцировать от ящура, контагиозного пустулезного дерматита (эктимы), оспы, везикулярного стоматита, злокачественной катаральной лихорадки, сердечной водянки, болезни Найроби, лихорадки долины Рифт и некробактериоза.
 2014-02-17
2014-02-17 1084
1084
