Колебания Молекул
В отличие от видимого и ультрафиолетового диапазонов, которые обусловлены главным образом переходами электронов из одного стационарного состояния в другое, в инфракрасном диапазоне спектра проявляются в основном колебательные и вращательные степени свободы движения атомов. Это могут быть, к примеру, колебательные движения атомов в молекуле, вращение молекулы как целого вокруг оси проходящей через центр масс или коллективные колебания атомов кристаллической решетки, так называемые фононы, и т.д. Оказывается, что изучение данных видов движения современными теоретическими и экспериментальными средствами спектроскопии, является мощным инструментом, которые позволяют не только объяснить особенности колебательных спектров, но и выявить структуру колеблющейся системы, изучить физику протекающих в ней процессов.
Теоретическая спектроскопия, изучающая переходы атомной системы с одного энергетического уровня на другой под действием электромагнитного излучения, начинается с изучения собственных значений энергии системы. Они находятся в результате решения уравнения Шредингера
Hy=Ey,
где H – гамильтониан системы, y и E - собственные функции и значения.
Поскольку молекула состоит из ядер и электронов, ее гамильтониан можно представить как сумму двух частей:
H = Hяд + Hэл.
Первое слагаемое описывает движение ядер, второе – электронов «вокруг» ядер. Ядра имеют массу более чем на три порядка превышающую массу электрона, и поэтому движутся значительно медленнее их. В первом приближении можно считать движения ядер и электронов независимыми. Приближение о независимости движений электронов и ядер называется адиабатическим, или приближением Борна-Оппенгеймера, которые ввели его в 1927 году.
Пользуясь данным приближением, Борн и Оппенгеймер показали, что с хорошей точностью полную энергию молекулы можно представить как сумму трех независимых вкладов:
E = Eэл + Eкол + Eвращ.
Здесь Eэл – энергия электронов, Eкол – энергия колебаний ядер (подразумевается колебательное отклонение ядер от равновесного положения при неподвижном центре масс молекулы), Eвращ – энергия вращения молекулы как целого. Существенно, что Eэл >> Eкол >> Eвращ. Такое соотношение определяет своеобразную структуру энергетических уровней молекулы. Каждый электронный уровень, который мы будем обозначать квантовым числом u =0, 1, …, сопровождается своим набором колебательных уровней, квантовые числа n =0, 1, …, а те, в свою очередь, имеют вращательную структуру, квантовые числа j =0, 1, …. Схема энергетических уровней молекулы показана на рис. 1.
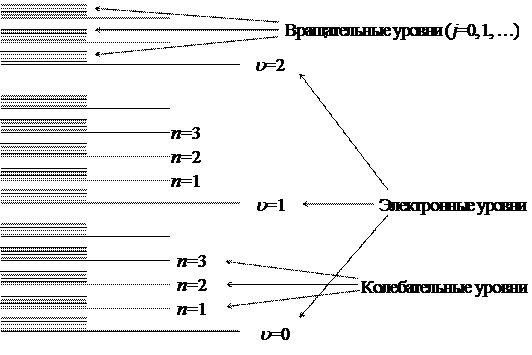
Рис. 1. Схема энергетических уровней молекулы
Пример колебательно-вращательного спектра газа 1H35Cl в основном электронном состоянии (u =0) приведен на рис. 2. (a) (см. [[1]]). Здесь по горизонтальной оси отложено волновое число (волновое число определяется как единица, деленная на длину волны в сантиметрах). На рис. 2. (b) изображена схема энергетических уровней и переходов, соответствующих колебательно-вращательным линиям рис. 2. (a). Серия линий A является чисто вращательной – она возникает благодаря только переходам между вращательными уровнями основного колебательного состояния (n =0). Переходы с уровня n =0 на уровни n =1 и n =2 ответственны за линии B и C. Чисто колебательные переходы, когда вращательное квантовое число не изменяется (D j =0), для молекул HCl запрещены правилами отбора. Поэтому в сериях B и C отсутствуют центральные линии. В случае, когда вращательная степень свободы отсутствует (например, для молекул в матрицах), отсутствует и серия A, а вместо серий B и С имеют место одиночные линии на месте «пропущенных» центральных линий, соответствующие переходам n =0→ n =1 и n =0→ n =2 соответственно. Переходы с нулевого на первый колебательный уровень (B) называются основным тоном или первой гармоникой, переходы с нулевого на второй (C) – первым обертоном (или второй гармоникой) и т.д. Конечно, возможны переходы n =0→ n =3 – второй обертон (третья гармоника), n =0→ n =4 – третий обертон (четвертая гармоника) и т.д. Однако интенсивности соответствующих им линий низки и данные линии на рис. 2 не отображены.
Мы ограничимся рассмотрением лишь колебательных спектров молекул. Как правило, для молекул находящихся в матричной изоляции, да еще и при низких температурах, вращение практически отсутствует. Однако заметим, что при комнатных температурах, когда размеры молекул малы по сравнению с характерными размерами матрицы, вращательные степени свободы могут проявляться в виде либрационных спектров или даже в виде спектров почти свободного (заторможенного) вращения.
Доклад Афанасьева АД D1 High Res 2009 Ирк
|
|
|
|
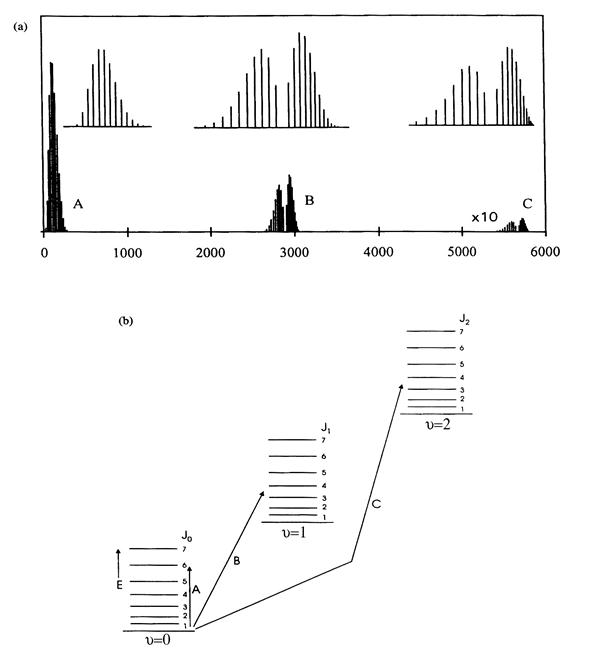 Рис. 2. (a) Схема вращательно-колебательного спектра 1H35Cl. Для наглядности высота группы линий C на рисунке увеличена в 10 раз. В верхней части рисунка показаны те же группы линий A, B и C, что и внизу, но в более удобном для визуального сопоставления масштабе. (b) Колебательно-вращательные энергетические уровни молекулы 1H35Cl. Стрелками показаны переходы, соответствующие линиям в спектре. Переходы с нулевого колебательного уровня на первый (B) называются основным тоном, переходы с нулевого на второй (C) – первым обертоном.
Рис. 2. (a) Схема вращательно-колебательного спектра 1H35Cl. Для наглядности высота группы линий C на рисунке увеличена в 10 раз. В верхней части рисунка показаны те же группы линий A, B и C, что и внизу, но в более удобном для визуального сопоставления масштабе. (b) Колебательно-вращательные энергетические уровни молекулы 1H35Cl. Стрелками показаны переходы, соответствующие линиям в спектре. Переходы с нулевого колебательного уровня на первый (B) называются основным тоном, переходы с нулевого на второй (C) – первым обертоном. 2014-02-09
2014-02-09 1206
1206
