Схема неконкурентноеого ингибирования
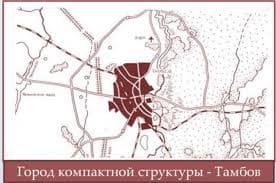
Неконкурентное ингибирование - это торможение ферментативной реакции, вызванное влиянием ингибитора на каталитическое превращение субстрата. При этом ингибитор не влияет на связывание фермента с субстратом. Неконкурентный ингибитор может связываться либо с каталитическими группами активного центра фермента, либо вне активного центра фермента, но при этом он изменяет конформацию фермента и затрагивает каталитический участок его активного центра. При неконкурентном ингибировании, возможно образование тройного, неактивного комплекса.
Введение сульфаниламидов приводит к ингибированию ферментов бактерий, которые синтезируют фолиевую кислоту. Нарушение синтеза этой кислоты проводит к нарушению роста микроорганизмов и их гибели.
Эти препараты имеют структурное сходство с парааминобензойной кислотой, которая используется бактериями для синтеза фолиевой кислоты, необходимой для роста и размножения бактерий
Многие лекарственные препараты действуют по типу конкурентного ингибитора. При этом они тормозят активность ряда ферментов, необходимых для функционирования бактериальных клеток. Примером является применение сульфаниламидов. При различных инфекционных заболеваниях, которые вызываются бактериями, применяются сульфаниламидные препараты.
Конкурентным ингибитором данной реакции является малоновая кислота, поэтому с активным центром фермента связывается и та, и другая кислота, в зависимости от их соотношения в растворе. Чтобы снять частично или полностью действие конкурентного ингибитора, нужно повысить концентрацию субстрата. При этом весь фермент будет находиться в форме фермент-субстратного комплекса, а доля комплекса фермент-ингибитор будет резко понижаться, поэтому скорость ферментативной реакции может быть максимальной даже в присутствии ингибитора.
По принципу конкурентных ингибиторов действует целая группа различных препаратов – это антихолинэстеразы. Они являются конкурентными ингибиторами фермента холинэстеразы, катализирующего гидролиз ацетилхолина. Ацетилхолин обеспечивает проведение нервного импульса. Антихолинэстеразы конкурируют с ацетилхолином за активный центр фермента холинэстеразы. В результате этого распад ацетилхолина тормозится, он накапливается в организме, вызывая нарушение проведения нервного импульса.


В качестве неконкурентного ингибитора выступают цианиды. Они прочно связываются с ионами железа, которые входят в состав каталитического геминового фермента -цитохромоксидазы. Этот фермент является одним из компонентов дыхательной цепи. Блокирование дыхательной цепи выключает её из работы, что приводит к мгновенной гибели организме.
Примером неконкурентного ингибитора является действие солей тяжёлых металлов. Они блокируют -SH группы, которые входят в каталитический участок фермента. При этом образуется комплекс фермент-ингибитор. Он способен присоединять субстрат, но дальнейшего превращения субстрата не происходит, т.к. каталитические группы фермента заблокированы. Реакция непродуктивна. Снять действие неконкурентного ингибитора очень сложно, т.к. ионы металлов очень прочно связываются с активным центром фермента. Действие этого ингибитора можно снять только с помощью специальных веществ - реактиваторов.
3.Субстратное ингибирование - это торможение ферментативной реакции, вызванное избытком субстрата. При этом образуется фермент-субстратный комплекс, но он не подвергается каталитическим превращениям, т.к. делает молекулу фермента неактивной. Действие субстратного ингибитора снимается путём уменьшения концентрации субстрата.
4.Аллостерическое ингибирование характерно для ферментов, имеющих четвертичную структуру, молекула которых состоит из нескольких единиц (протомеров). Аллостерические ферменты могут иметь 2 и более единиц. При этом одна имеет каталитический центр и называется каталитической, а другая - аллостерический центр и называется регуляторной. В отсутствии аллостерического ингибитора субстрат присоединяется к каталитическому центру, и идёт обычная каталитическая реакция. При появлении аллостерического ингибитора, он присоединяется к регуляторной единице, т.е. к аллостерическому центру, и изменяет конформацию центра фермента, в результате этого активность фермента снижается.
| Предыдущий раздел | Раздел верхнего уровня | Следующий раздел |
ОБМЕН УГЛЕВОДОВ
1. Основные углеводы животного организма, их биологическая роль.
2. Превращение углеводов в органах пищеварительной системы.
3. Биосинтез и распад гликогена в тканях.
4. Гликогеновые болезни.
Углеводы - это полиоксикарбонильные соединения и их производные.
Основными углеводами организма человека являются:
1. Моносахариды (глицеральдегид, диоксиацетон,эритроза, рибоза, дезоксирибоза, рибулоза, ксилулоза,глюкоза, галактоза, фруктоза, манноза, арабиноза и др.);
2. Олигосахариды (мальтоза, лактоза, сахароза);
3. Гомополисахариды (крахмал, гликоген, клетчатка);
4. Гетерополисариды (гиалуроновая кислота, хондроитинсульфат, дерматансульфат, кератансульфат, гепарин).
- 3.1. Биологическая роль углеводов
- 3.2. Превращение углеводов в пищеварительном тракте
- 3.3. Биосинтез и распад гликогена
- 3.4. Основные пути катаболизма глюкозы
- 3.4.1. Анаэробный гликолиз
- 3.4.2. Аэробный гликолиз (гексозодифосфатный путь)
- 3.4.3. Гексозомонофосфатный путь
- 3.4.4. Глюконеогенез
| Раздел верхнего уровня | Следующий раздел |
 2014-02-17
2014-02-17 909
909