Вещества, растворы которых проводят электрический ток, называются электролитами.
К ним относятся растворы солей, кислот, щелочей.
При растворении электролитов под влиянием электрического поля полярных молекул воды происходит распад молекул электролитов на ионы. Этот процесс называется электролитической диссоциацией.
Например, при растворении в воде молекулы медного купороса 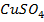 распадаются на положительные ионы меди
распадаются на положительные ионы меди 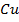 и отрицательные ионы
и отрицательные ионы 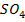 (кислотный остаток).
(кислотный остаток).
При прохождении электрического тока через водный раствор медного купороса у положительного электрода (анода) выделяется кислотный остаток, а на отрицательном электроде (катоде) выделяется медь. Т.е. в жидкостях ионная проводимость.
Электролиз – это процесс выделение на электроде вещества под действием электрического тока.
Масса вещества, выделившегося на электроде, вычисляется по формуле:
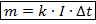 закон Фарадея
закон Фарадея
k – электрохимический эквивалент вещества (зависит от природы вещества), (кг/Кл),
I – сила тока, измеряется в Амперах (А),
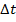 - промежуток времени, в течении которого проходил ток, (с).
- промежуток времени, в течении которого проходил ток, (с).
Электролиз применяется для очистки металлов от примесей, для покрытия поверхности одного металла тонким слоем другого, для получения копий с рельефных поверхностей.
 2014-02-17
2014-02-17 1579
1579








