Все многообразие биохимических свойств природных белков обусловлено последовательностью соединения аминокислот с различными боковыми радикалами – R-группами в их полипептидной цепи.
Схематично боковые цепи полипептидов могут быть представлены следующим образом:

Различие химических свойств R-групп аминокислот ведет к появлению в структуре белковой молекулы химических связей различной прочности – дисульфидных, водородных, ионных связей и гидрофобных взаимодействий.
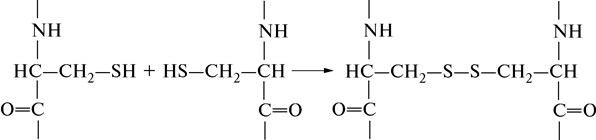
Дисульфидная связь. Пептидные цепочки аминокислот (в белке их может быть одна, две или несколько) могут быть сшиты внутри себя или между собой за счет образования ковалентной дисульфидной связи –S–S– между сульфгидрильными группами –SН, расположенными в полипептидной цепи цистеинов:
Водородная связь. Водородные связи возникают в результате дипольных взаимодействий между ковалентно связанным водородным атомом, имеющим положительный заряд, и отрицательно заряженным ковалентно связанным атомом – акцептором. Ниже приведены примеры различных водородных связей (обозначены пунктиром), образующихся в белках.
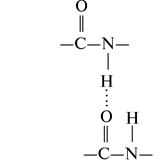
Водородная связь между пептидными группами:
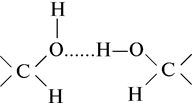
Водородная связь между двумя гидроксильными группами:
Водородная связь между заряженной карбоксильной группой и гидроксильной группой тирозина:
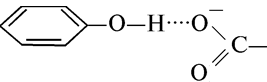
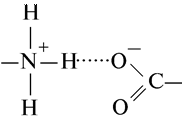
Водородная связь между заряженной аминной группой и заряженной карбоксильной группой:
Водородная связь между гидроксильной группой серина и карбонильной пептидной связи:
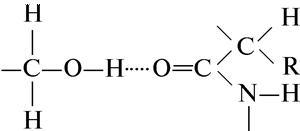
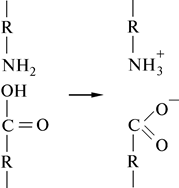
Солевая связь. Такие кислоты, как лизин и аспарагиновая, могут образовывать солевые или ионные связи:
Гидрофобное взаимодействие. Если ионные и водородные связи возникают в результате дипольных взаимодействий полярных атомов или заряженных групп двух или более полярных молекул, то гидрофобные взаимодействия связывают неполярные (гидрофобные) части одной или нескольких молекул в водных растворах. Энергия каждого такого взаимодействия мала, но из-за большого числа таких взаимодействий они способны создавать устойчивые структуры.
Под влиянием гидрофобных взаимодействий происходит сближение неполярных участков полипептидной цепи за счет вытеснения молекул воды и ослабления их взаимодействия с водной средой.
Способностью к гидрофобному взаимодействию обладают боковые цепи (R-группы) валина, лейцина, изолейцина, фенилаланина, пролина, триптофана, метионина и цистеина.
Ионнные, водородные связи и гидрофобные взаимодействия определяют и стабилизируют специфическую пространственную структуру молекулы каждого белка.
 2014-02-09
2014-02-09 1148
1148
