Оксидазный путь использования кислорода в клетке
Причины и последствия повреждений митохондрий
Метаболические и гомеостатические функции митохондрий
Локализации ферментов митохондрий
1). Наружная мембрана содержит: а). элонгазы, ферменты удлиняющие молекулы насыщенных жирных кислот; б). кинуренингидроксилазу; в). моноаминооксидазу (маркер) и др.
2). Межмембранное пространство содержит: а). аденилатциклазу; б). нуклеозиддифосфаткиназы.
3). Внутренняя мембрана содержит: а). ферменты цепи окислительного фосфорилирования, из них цитохромоксидаза - маркер; б). СДГ в). β-оксибутират ДГ; г). карнитинацилтрансферазу.
4). Матрикс содержит: а). ферменты ЦТК; б). ферменты β-окисления жирных кислот; в). аминотрансферазы АСТ, АЛТ; г). глутамат ДГ д). фосфоенолпируваткарбоксилазу е). пируват ДГ.
В клетке содержится от сотни до тысячи митохондрий, их размер 2-3 мкм в длину и 1 мкм в ширину.
В митохондриях происходит: синтез АТФ и теплопродукция в реакция окислительного фосфорилирования; β-окисления жирных кислот; реакции ЦТК, через ЦТК протекают некоторые реакции глюконеогенеза, переаминирования, дезаминирования, липогенеза и синтеза гема, осуществляется интеграция белкового, липидного и углеводного обмена.
Повреждение внутренней мембраны митохондрий химическими и физическими факторами приводит к нарушению процесса синтеза АТФ, торможению анаболических реакций, межмембранного транспорта и всех видов обмена веществ.
- окислительное фосфорилирование
Оксидазный путь использования кислорода состоит из процессов окисления и фосфорилирования, которые между собой сопряжены. В нем участвует около 40 различных белков. Оксидазный путь потребляет 90% О2, является основным источником АТФ в аэробных клетках.
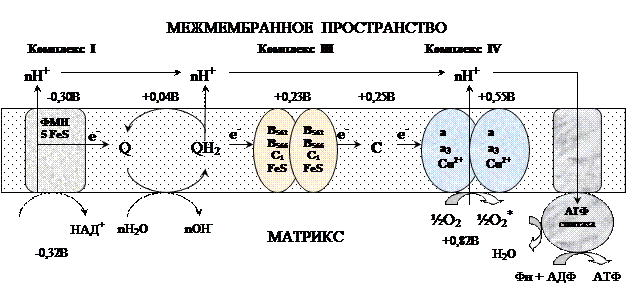
Окислительным фосфорилированием называют синтез АТФ из АДФ и Н3РО4 за счет энергии переноса электронов по ЦПЭ. При окислении выделяется 220 кДж/моль свободной энергии. На синтез 3 АТФ расходуется: 30,5*3=91,5 кДж/моль. В виде тепла выделяется: 220-91,5=128,5 кДж/моль. КПД = 40%.НАДН2 + ½О2 → НАД+ + Н2О + 220 кДж/мольАДФ + Н3РО4 + 30,5 кДж/моль = АТФ + Н2О 1). Цепь окисления (дыхательная цепь) состоит из 4 белковых комплексов, которые определенным образом встроены во внутреннюю мембрану митохондрий и небольших подвижных молекул убихинона и цитохрома С, которые циркулируют в липидном слое мембраны между белковыми комплексами.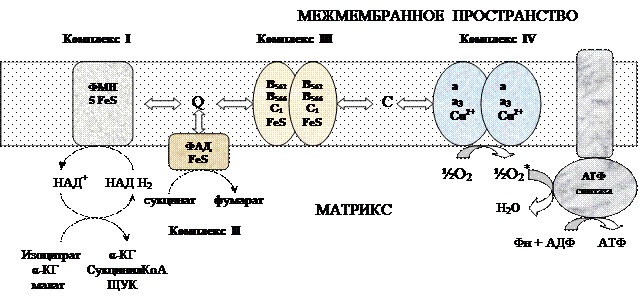 Комплекс I – НАДН2 дегидрогеназный комплекс – самый большой из дыхательных ферментных комплексов – имеет молекулярную массу свыше 800КДа, состоит из более 22 полипептидных цепей, в качестве коферментов содержит ФМН и 5 железо-серных (Fe2S2 и Fe4S4) белков. Комплекс II – СДГ. В качестве коферментов содержит ФАД и железо-серный белок. Комплекс III – Комплекс b-c1 (фермент QH2 ДГ), имеет молекулярную массу 500КДа, состоит из 8 полипептидных цепей, и вероятно существует в виде димера. Каждый мономер содержит 3 гема, связанных с цитохромами b562, b566, с1, и железо-серный белок. Комплекс IV – Цитохромоксидазный комплекс имеет молекулярную массу 300КДа, состоит из 8 полипептидных цепей, существует в виде димера. Каждый мономер содержит 2 цитохрома (а и а3) и 2 атома меди. Коэнзим Q (убихинон). Липид, радикал которого у млекопитающих образован 10 изопреноидными единицами (Q10). Убихинон переносит по 2Н+ и 2е-.
Комплекс I – НАДН2 дегидрогеназный комплекс – самый большой из дыхательных ферментных комплексов – имеет молекулярную массу свыше 800КДа, состоит из более 22 полипептидных цепей, в качестве коферментов содержит ФМН и 5 железо-серных (Fe2S2 и Fe4S4) белков. Комплекс II – СДГ. В качестве коферментов содержит ФАД и железо-серный белок. Комплекс III – Комплекс b-c1 (фермент QH2 ДГ), имеет молекулярную массу 500КДа, состоит из 8 полипептидных цепей, и вероятно существует в виде димера. Каждый мономер содержит 3 гема, связанных с цитохромами b562, b566, с1, и железо-серный белок. Комплекс IV – Цитохромоксидазный комплекс имеет молекулярную массу 300КДа, состоит из 8 полипептидных цепей, существует в виде димера. Каждый мономер содержит 2 цитохрома (а и а3) и 2 атома меди. Коэнзим Q (убихинон). Липид, радикал которого у млекопитающих образован 10 изопреноидными единицами (Q10). Убихинон переносит по 2Н+ и 2е-. 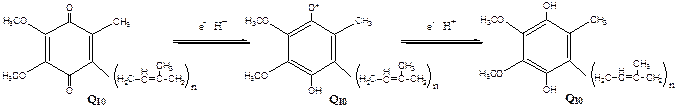 убихинон ↔ семихинон ↔ гидрохинон Цитохром с. Периферический водорастворимый мембранный белок с массой 12,5КДа, содержит 1 полипептидную цепь из 100 АК, и молекулу гема.Молекулярные соотношения между компонентами дыхательной цепи отличаются в разных тканях. Например, в миокарде, на 1 молекулу НАДН2 дегидрогеназного комплекса приходиться 3 молекулы комплекса b-c1, 7 молекул цитохромоксидазного комплекса, 9 молекул цитохрома С и 50 молекул убихинона. 2). Фосфорилирование осуществляется АТФ-синтетазой (Н+-АТФ-аза) — интегральным белком внутренней мембраны митохондрий. АТФ-синтаза состоит из 2 белковых комплексов, обозначаемых как F0 и F1. Гидрофобный комплекс F0 погружён в мембрану.
убихинон ↔ семихинон ↔ гидрохинон Цитохром с. Периферический водорастворимый мембранный белок с массой 12,5КДа, содержит 1 полипептидную цепь из 100 АК, и молекулу гема.Молекулярные соотношения между компонентами дыхательной цепи отличаются в разных тканях. Например, в миокарде, на 1 молекулу НАДН2 дегидрогеназного комплекса приходиться 3 молекулы комплекса b-c1, 7 молекул цитохромоксидазного комплекса, 9 молекул цитохрома С и 50 молекул убихинона. 2). Фосфорилирование осуществляется АТФ-синтетазой (Н+-АТФ-аза) — интегральным белком внутренней мембраны митохондрий. АТФ-синтаза состоит из 2 белковых комплексов, обозначаемых как F0 и F1. Гидрофобный комплекс F0 погружён в мембрану. 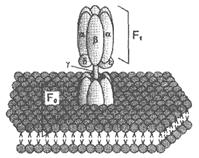 | Он служит основанием, которое фиксирует АТФ-синтазу в мембране. Комплекс F0 состоит из нескольких субъединиц, образующих канал, по которому протоны переносятся в матрикс. Комплекс F1 выступает в митохондриальный матрикс. Он состоит из 9 субъединиц (3α, 3β, γ, δ, ε). Субъединицы α и β уложены попарно, образуя «головку»; между а- и β-субъединицами располагаются 3 активных центра, в которых происходит синтез АТФ; γ, δ, ε – субъединицы связывают комплекс F1, с F0. |
1. Внутренняя мембрана митохондрий непроницаема для всех ионов.
2. Она содержит ряд белков-переносчиков, осуществляющих транспорт необходимых метаболитов и неорганических ионов.
3. При прохождении электронов по дыхательной цепи внутренней мембраны происходит перемещение Н+ из матрикса в межмембранное пространство.
4. При достаточно большом протонном градиенте протоны начинают «течь» через АТФ-синтетазу, что сопровождается синтезом АТФ.
Современные представления В настоящее время открыты все основные компоненты ЦПЭ ОФ, изучено их строение, свойства. Открыты основные принципы окислительного фосфорилирования, механизмы некоторых стадий, регуляция окислительного фосфорилирования. Механизм окисления Комплексы цепи окисления располагаются в мембране в порядке повышения их редокс-потенциала. При переходе электрона от комплекса с низким редокс-потенциалом к комплексу с более высоким редокс-потенциалом происходит выделение свободной энергии.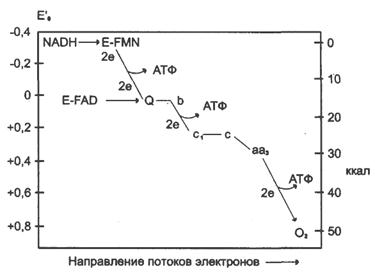 Изменение свободной анергии при переносе электронов по ЦПЭ. E-FMN — комплекс I; E-FAD — комплекс II, b-c1 — комплекс III; aa3 — комплекс IV. Часть этой свободной энергии используется для переноса протонов из матрикса митохондрий в межмембранное пространство, при этом на внутренней мембране создается протонный градиент (∆рН) (в матриксе рН выше, чем в цитозоле). Так как каждый протон несет положительный заряд, на мембране появляется разность потенциалов (∆V), внутренняя сторона мембраны заряжается отрицательно, внешняя – положительно. В совокупности протонный градиент и разность потенциалов составляют электрохимический потенциал, который в типичной клетке составляет около 220 мВ, и складывается из 160 мВ ∆V и 60 мВ ∆рН (при ∆рН=1). Механизм переноса протонов через мембрану до конца не изучен. Вероятно, у разных компонентов дыхательной цепи существуют разные механизмы сопряжения транспорта е- с перемещением Н+. Однако установлено что важную роль в этом процессе играет КоQ. Цепь окисления 1. 2е- от НАДН2, проходят через I комплекс (ФМН→SFe белок) на КоQ, высвобождаемая при этом энергия обеспечивает перекачку Н+ (механизм переноса Н+ неизвестен).2. КоQ с 2е- забирает 2Н+ из матрикса и превращается в КоQН2 (восстановление КоQ проходит также с участием комплекса II).3. КоQН2 переносит 2е- на комплекс III, а 2Н+ в межмембранное пространство.4. Цитохром С переносит е- c III комплекса на IV комплекс.5. IV комплекс сбрасывает е- на О2, высвобождаемая при этом энергия обеспечивает перекачку Н+ (механизм переноса Н+ неизвестен).
Изменение свободной анергии при переносе электронов по ЦПЭ. E-FMN — комплекс I; E-FAD — комплекс II, b-c1 — комплекс III; aa3 — комплекс IV. Часть этой свободной энергии используется для переноса протонов из матрикса митохондрий в межмембранное пространство, при этом на внутренней мембране создается протонный градиент (∆рН) (в матриксе рН выше, чем в цитозоле). Так как каждый протон несет положительный заряд, на мембране появляется разность потенциалов (∆V), внутренняя сторона мембраны заряжается отрицательно, внешняя – положительно. В совокупности протонный градиент и разность потенциалов составляют электрохимический потенциал, который в типичной клетке составляет около 220 мВ, и складывается из 160 мВ ∆V и 60 мВ ∆рН (при ∆рН=1). Механизм переноса протонов через мембрану до конца не изучен. Вероятно, у разных компонентов дыхательной цепи существуют разные механизмы сопряжения транспорта е- с перемещением Н+. Однако установлено что важную роль в этом процессе играет КоQ. Цепь окисления 1. 2е- от НАДН2, проходят через I комплекс (ФМН→SFe белок) на КоQ, высвобождаемая при этом энергия обеспечивает перекачку Н+ (механизм переноса Н+ неизвестен).2. КоQ с 2е- забирает 2Н+ из матрикса и превращается в КоQН2 (восстановление КоQ проходит также с участием комплекса II).3. КоQН2 переносит 2е- на комплекс III, а 2Н+ в межмембранное пространство.4. Цитохром С переносит е- c III комплекса на IV комплекс.5. IV комплекс сбрасывает е- на О2, высвобождаемая при этом энергия обеспечивает перекачку Н+ (механизм переноса Н+ неизвестен).
|
 Созданный в цепи окисления электрохимический потенциал используется на: 40-45% для фосфорилирования; на 25% для транспорта веществ через мембрану и на 30-35% для теплопродукции. I, III и IV комплексы ЦПЭ называют пунктами сопряжения дыхания и фосфорилирования, так как они создают электрохимический потенциал, необходимый для фосфорилирования. 1). Механизм фосфорилирования АТФ-синтетаза обеспечивает обратимое взаимопревращение энергии электрохимического потенциала и энергии химических связей. Электрохимический потенциал заставляет Н+ двигаться по каналу АТФ-синтазы в матрикс. При каждом переносе протонов через канал Fo энергия электрохимического потенциала расходуется на поворот стержня, в результате которого циклически изменяется конформация а- и β-субъединиц и все 3 активных центра, образованных парам α- и β-субъединиц, катализируют очередную фазу цикла 1) связывание АДФ и Н3РО4; 2) образование фосфоангидридной связи АТФ; 3) освобождение конечного продукта АТФ. Таким образом, электрохимический потенциал, генерируемый в каждом из 3 пунктов сопряжения дыхания и фосфорилирования, используется для синтеза одной молекулы АТФ.
Созданный в цепи окисления электрохимический потенциал используется на: 40-45% для фосфорилирования; на 25% для транспорта веществ через мембрану и на 30-35% для теплопродукции. I, III и IV комплексы ЦПЭ называют пунктами сопряжения дыхания и фосфорилирования, так как они создают электрохимический потенциал, необходимый для фосфорилирования. 1). Механизм фосфорилирования АТФ-синтетаза обеспечивает обратимое взаимопревращение энергии электрохимического потенциала и энергии химических связей. Электрохимический потенциал заставляет Н+ двигаться по каналу АТФ-синтазы в матрикс. При каждом переносе протонов через канал Fo энергия электрохимического потенциала расходуется на поворот стержня, в результате которого циклически изменяется конформация а- и β-субъединиц и все 3 активных центра, образованных парам α- и β-субъединиц, катализируют очередную фазу цикла 1) связывание АДФ и Н3РО4; 2) образование фосфоангидридной связи АТФ; 3) освобождение конечного продукта АТФ. Таким образом, электрохимический потенциал, генерируемый в каждом из 3 пунктов сопряжения дыхания и фосфорилирования, используется для синтеза одной молекулы АТФ. Коэффициентом окислительного фосфорилирования (Р/О) называют отношение количества фосфорной кислоты (Р), использованной на фосфорилирование АДФ, к атому кислорода (О), поглощённого в процессе дыхания. Окисление молекулы НАДН2 в ЦПЭ сопровождается образованием 3 молекул АТФ, следовательно, для НАДН2 Р/О = 3. Электроны от ФАД-зависимых дегидрогеназ поступают в ЦПЭ на KoQ, минуя первый пункт сопряжения. Поэтому образуются только 2 молекулы АТФ, следовательно, для сукцината Р/О = 2. Эти величины отражают теоретический максимум синтеза АТФ, фактически эта величина меньше из-за затрат на транспорт.
 2014-02-17
2014-02-17 7764
7764








