Механизмы репликации ДНК у эукариот менее изучены из-за их большей сложности. Основные результаты получены на модельной системе с ДНК вируса SV40, в которой процесс репликации исследовали в зараженных клетках человека, культивируемых in vitro. В этой системе вирусный белок, называемый Т-антигеном, выполняет многие функции, необходимые для репликации вирусной ДНК. Он является белком-инициатором, обладает ДНК-хеликазной активностью и необходим для правильного взаимодействия с ДНК ферментного комплекса, синтезирующего праймеры. В то же время вирус SV40 использует для репликации своей небольшой хромосомы и многие белки клетки-хозяина, что позволяет исследовать функционирование репликативного комплекса клеток человека в такой относительно простой системе.
ДНК-полимеразы эукариот. В клетках эукариот имеются по меньшей мере шесть различных ДНК-зависимых ДНК-полимераз: α, β, δ,ε,γ,ζ. Четыре из них — α, β, δ,ε — непосредственно участвуют в репликации хромосомной ДНК (табл. 18).
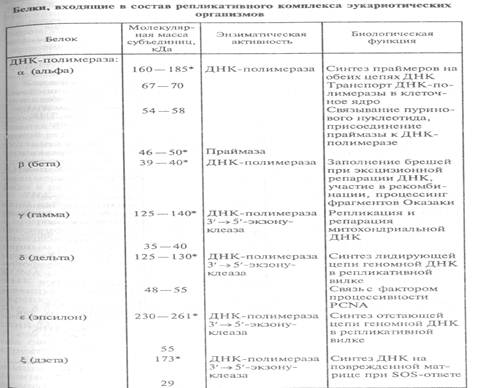
ДНК-полимераза α — первая ДНК-полимераза, обнаруженная в клетках эукариот. Она представлена в клетке в виде прочного комплекса с ДНК-праймазой — ферментом, осуществляющим синтез РНК-затравок. Комплекс ДНК-полимераза α-праймаза является единственным у эукариот ферментативным ансамблем, способным инициировать синтез ДНК de novo. В ходе репликации в клеточных ядрах ДНК полимераза α-праймаза синтезирует затравку лидирующей нити в участке ori и затравки фрагментов Оказаки запаздывающей нити. Как правило, ДНК-полимераза не обладает корректорской 3'→5'-экзонуклеазной активностью. По-видимому, в ходе эволюции экзонуклеазный центр в данном ферменте редуцировался.
ДНК-полимераза β является наименьшей по размеру и самой простой по строению ДНК-полимеразой в клетках эукариот. Основная функция ДНК-пол.β в клетке связана с эксцизионной репарацией ядерной ДНК (заполнение пробелов при репарации).
ДНК-полимераза δ — гетеродимер, состоящий из каталитической субъединицы (125—130 кДа) и субъединицы 48 — 55 кДа, необходимой для преодоления ферментом структурных барьеров в природных однонитевых матрицах и для связи с фактором процессивности PCNA (от англ. Proliferating Cell Nuclear Antigen –ядерный антиген пролиферирующих клеток). Три молекулы PCNA образуют кольцевой тример с отверстием для двунитевой ДНК в центральной части, который представляет собой перемещающуюся по ДНК подвижную платформу или «скользящую скрепку» в форме тора (бублика), удерживающую ДНК-полимеразу δ в ходе полимеризации на матрице и обеспечивающую высокопроцессивный синтез ДНК. Хотя PCNA и прокариотический фактор процессивности субъединица β ДНК-полимеразы III Е. coli имеют низкую гомологию на уровне первичной структуры, оба белка формируют близкие по пространственной геометрии структуры «скользящей скрепки».
ДНК-полимераза ε, выделена из клеток HeLa, содержит два полипептида — каталитический 261 кДа и полипептид 55 кДа. Каталитический полипептид обладает ДНК-полимеразной и 3'→5‘-экзонуклеазной активностями. Особенностью холофермента ДНК-полимеразы ε по сравнению с ДНК-полимеразой δ является его меньшая зависимость от вспомогательных факторов (PCNA, RFС - репликативный фактор С и RPA – репликативный ядерный белок А), а также низкая (почти на порядок) скорость синтеза ДНК. Это различие, возможно, связано с разной функцией ДНК-полимераз в репликативной вилке. Один холофермент, ДНК-полимераза δ осуществляет быстрый и процессивный синтез лидирующей нити, используя для элонгации единственную
затравку, синтезируемую ДНК-полимеразой α-праймазой в районе ori, и диссоциирует только по достижении конца репликона, тогда как несколько холоферментов ДНК-полимеразы ε могут одновременно синтезировать фрагмены Оказаки в «зоне Оказаки», удлиняя затравки, синтезируемые ДНК-полимеразой α-праймазой в начале каждого фрагмента.
ДНК-полимераза γ локализована в митохондриях, ее функция связана с репликацией и репарацией митохондриальной ДНК, она кодируется ядерным геномом. ДНК-полимераза γ способна направлять высокопроцессивную полимеризацию на однонитевых ДНК-матрицах в отсутствие вспомогательных факторов.
Охарактеризованы также другие ДНК-полимеразы эукариот: ή, θ, REV1 и др. Все эти ферменты участвуют в репарации ДНК.
В последние годы наряду с углубленным изучением строения и свойств отдельных ДНК-полимераз эукариот большое внимание уделяется взаимодействию этих ферментов со вспомогательными факторами и механизму функционирования их в составе многокомпонентных репликативных и репаративных комплексов. Список белков, взаимодействующих с ДНК-полимеразами, постоянно растет и включает не только известные факторы PCNA, RFC и RPA, но и ключевые факторы регуляции клеточного метаболизма, такие, как белки группы МСМ (minichromosome maintenance factors), факторы узнавания участков ori репликации ORC (origin recognition complex) и др.
Таким образом, поскольку эукариотические ДНК-полимеразы α и β лишены 3′ → 5 ′ и 5 ′ → 3 ′ -экзонуклеазных активностей, становится понятным участие ДНК-полимераз δ и ε в процессе репликации ядерной ДНК в качестве корректирующих ферментов, а ДНК-полимеразе ε приписывают также функцию удаления РНК-праймеров на концах фрагментов Оказаки.
Модель работы димерной полимеразы(ДНК-пол.III); координация синтеза ДНК на комплементарных цепях
Элонгация репликации. Модель полуконсервативной прерывистой репликации ДНК в репликативной вилке представлена на рис. Дуплекс родительской молекулы ДНК расплетает АТР- зависимая хеликаза. Образующиеся одноцепочечные участки покрывает SSB-белок. ДНК-пол.III движется по одной из матричных цепей в направлении раскрывания вилки и синтезирует ведущую цепь ДНК. По другой, матричной цепи в том же направлении движется праймосома (комплекс белков, осуществляющий инициацию репликации). Время от времени, входящая в состав праймосомы праймаза (белок Dna G), Синтезирует РНК-затравки для отстающей цепи. Вторая молекула холофермента ДНК-пол. III удлиняет эти затравки до тех пор, пока не достигнет предыдущей затравки, т.е. она синтезирует фрагменты Оказаки длиной от 1000 до 2000 н. Удаление сегментов РНК с 5'-конца каждого фрагмента Оказаки осуществляет ДНК- пол.I, используя свою 5'→3'-кзонуклеазную активность. Заполнение брешей между фрагментами Оказаки катализируется той же ДНК-полимеразой I. Одноцепочечный разрыв зашивает ДНК-лигаза. Таким образом, из серии фрагментов Оказаки образуется новая цепь.
 2014-02-18
2014-02-18 10396
10396








