Сульфирование растворами триоксида серы и его комплексами
Сульфирование концентрированной серной кислотой и олеумом имеет ряд существенных недостатков: 1) дезактивация субстратов (аминов, азолов, пиридина и т.п.); 2) окисление и разрушение субстратов (углеводов, стероидов, ацидофобных соединений - фурана, пиррола, индола и т.д.); 3) необходимость утилизации большого количества серной кислоты. Сульфирование неводными растворами и комплексами серного ангидрида позволяет решить большинство этих проблем.
Это наиболее универсальный и перспективный метод, который позволяет сульфировать самые различные субстраты - от очень активных (например, фурана, тиофена, пиррола и т.п.) до инертных (например, азолов) и создавать практически безотходную технологию.
В качестве растворителя используют жидкий сернистый ангидрид, галогеналканы (дихлор-, тетрахлорэтан, метиленхлорид) и другие соединения.
Активность серного ангидрида зависит от полярности среды, которая влияет на поляризацию молекулы триоксида серы и величину +d заряда на атоме серы:
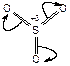 .
.
Варьируя растворитель или состав смеси растворителей можно менять сульфирующую активность SO3.
Механизм реакции SE
а) в полярных средах (например, жидком SO2), а также в неполярных средах при большом избытке SO3, принципиально не отличается от рассмотренного выше.
б) в неполярных инертных средах (1,2-дихлорэтан, тетрахлорэтан) при мольном соотношении реагентов качестве электрофила помимо SO3 выступает продукт его взаимодействия с образовавшейся сульфокислотой ArSO3SO3H.
А. Сульфирование аренов растворами триоксида серыв сернистом ангидриде (полярном растворителе) применяется в синтезе поверхностно-активных веществ ПАВ (алкиларенсульфонатов):
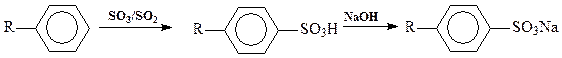
Реакция сильно экзотермическая, процесс ведут (т.к. среда SO2) при (-10°С). Отвод тепла осуществляется за счет испарения растворителя. Избыток серного ангидрида составляет обычно не более 5%. Процесс ведут непрерывным способом, технология практически безотходная. Диоксид серы используется как растворитель, и как сырьё для получения серного ангидрида.
Б. Сульфирование растворами SO3 в неполярных растворителях (дихлорэтане, метиленхлориде и других) широко используют в синтезе лекарственных веществ. Большой вклад в разработку этого метода внесла кафедра ХТЛВ.
1. Сульфирование карбоциклических аренов (бензола, нафталина и др.) В синтезе диазолина метод позволил увеличить выход 1,5-нафталин-дисульфокислоты почти вдвое, по сравнению с сульфированием H2SO4:
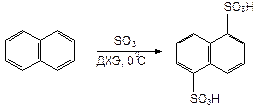
2. Сульфирование имидазола и тиазола (в ди- и тетрахлорэтане):
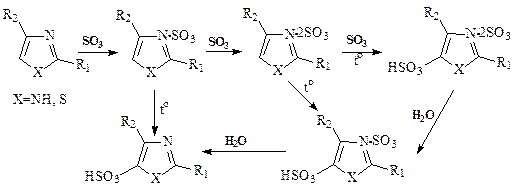
Метод обеспечивает:
- высокий выход целевых продуктов
- снижение температуры процесса со 160 – 250°С до 84°С,
- снижение расхода сульфирующего агента с 5-8 до 3, а в некоторых случаях до 1¸2 моль на моль субстрата.
3. Сульфирование ароматических аминов, в том числе БАВ в ДХЭ:
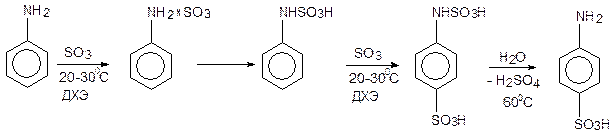
Метод отличается от «метода запекания» тем, что
- протекает в одну химическую стадию;
- позволяет проводить реакцию при 20-30°С (против 180°С);
- позволяет сократить время реакции до 1 часа;
- позволяет создать практически безотходное производство, так как дихлорэтановый фильтрат, содержащий непрореагировавший серный ангидрид и отогнанный (или отфильтрованный) исходный амин (метод относится и к замещенным аминам) возвращается в цикл.
Процесс в этом случае может быть проведен без деструкции субстрата вследствие отсутствия высокой температуры и кислотности среды.
4. Сульфатирование полисахаридов, например, декстрана и др.(дихлорэтан). При температуре 0¸5°С практически без деструкции образуется ценный биологически активный продукт (декстрансульфат, ронасан и др.) с выходом целевого продукта 80%. Механизм SN2, нуклеофил – кислород ОН – группы, большое значение имеют пространственные факторы.
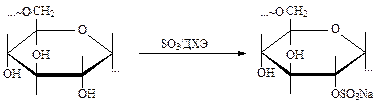
 2014-02-18
2014-02-18 1744
1744








