Перестройка электронной структуры атома, представляет собой гибридизацию атомных орбиталей. Из исходных s-, p-, d-орбиталей (электронных облаков) образуются равноценные гибридные орбитали (электронные облака), вытянутые по направлению к соседним атомам. При этом обеспечивается более полное перекрывание с облаками этих соседних атомов, что приводит к выигрышу энергии, достаточному, чтобы с избытком компенсировать затраты на деформацию исходных электронных облаков.
sp-Гибридизация происходит у орбиталей атомов элементов II группы периодической системы Д.И. Менделеева, при образовании галогенидов. Атомы этих элементов в нормальном состоянии имеют во внешнем уровне два спаренных s-электрона. В результате возбуждения один из s-электронов переходит в р-состояние, появляются два неспаренных электрона, один из которых s-электрон, другой р-электрон
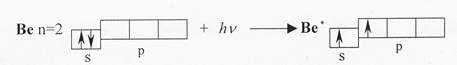
Энергия электронов р-подуровня выше, чем энергия электронов s-подуровня. Из исходных s- и р-орбиталей возбужденного атома бериллия (Be*) образуются две гибридные, одинаковые по энергии орбитали (облака) в форме неправильной гантели, расположенные под углом 180о друг к другу

При взаимодействии с р-орбиталями хлора, происходит перекрывание электронных облаков вдоль линии, соединяющей ядра взаимодействующих атомов. Форма молекул при sp-гибридизации линейная

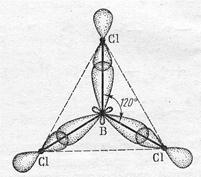
sp2-Гибридизация происходит у орбиталей атома бора и его аналогов. Возбужденный атом бора обладает тремя неспаренными электронами – одним s-электроном и двумя р-электронами
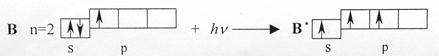
Из трех орбиталей образуются три эквивалентные sp2-гибридные орбитали, расположенные в одной плоскости под углом 120о друг к другу
Электронно-графическая формула фтора
В образовании молекулы ВF3 участвуют 3 гибридных электронных облака атома бора и три р-электронных облака атома фтора. Форма молекул молекулы ВF3 – правильный треугольник на плоскости
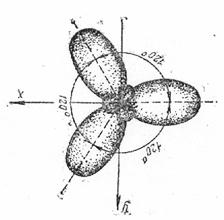
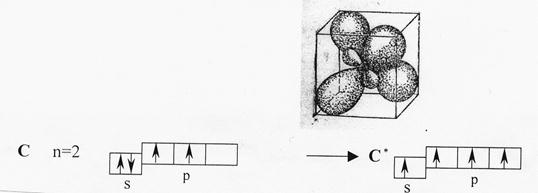
sp3-Гибридизация характерна для атомов углерода и его аналогов – кремния, германия. Из одной s- и трех р-орбиталей атомов в возбужденном состоянии образуются четыре гибридных орбитали, расположенные под углом 109,5о друг к другу, они направлены к вершинам тетраэдра, в центре которого находится атом углерода; ребрами тетраэдра являются диагонали сторон куба
Молекула СН4 имеет форму тетраэдра, причем все четыре С-Н связи сигма (σ) равноценны
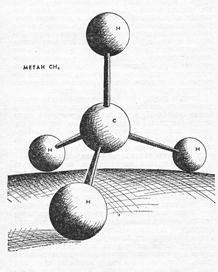
Пространственная структура СН4
В таблице даны типы гибридизации орбиталей и «архитектуры» молекул.
 2014-02-18
2014-02-18 5310
5310
