Гибридизация орбиталей и пространственная конфигурация молекул
| Тип молекулы | Исходные орбитали атома А | Тип гибридизации | Число гибридных орбиталей атома А | Пространственная конфигурация молекулы |
| АВ2 АВ3 АВ4 | s + p s + p + p s + p + p + p | sp sp2 sp3 | линейная треугольная тетраэдрическая |
При образовании двойных, тройных связей в органических соединениях (этилен, ацетилен) происходит перекрывание р-электронных облаков в плоскостях, перпендикулярно σ-связям и образование π-связей.
Атомы большинства металлов на внешнем энергетическом уровне содержат небольшое число электронов (1, 2. 3), это в основном s- и d-элементы. В обычных условиях металлы - кристаллические вещества (кроме ртути). На рисунке представлена схема кристаллической решетки натрия.
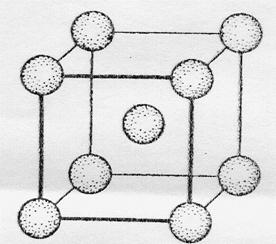
Кристаллическая решетка натрия
Как видно, каждый атом натрия окружен восемью соседними атомами. У атома натрия, как и у других металлов, имеется избыток валентных орбиталей и недостаток электронов. При сближении атомов в результате образования кристаллической решетки валентные орбитали соседних атомов перекрываются, благодаря чему электроны свободно перемещаются из одной орбитали в другую, осуществляя связь между всеми атомами кристалла металла. Такой тип химической связи называется металлической.
Между ковалентной и металлической связью имеется большое сходство – оба типа химической связи основаны на обобществлении валентных электронов. Только в металлах обобществленные электроны обслуживают весь кристалл, то есть они полностью делокализованы. Электроны, осуществляющие связь, обобществлены («электронный газ») и перемещаются по всему объему металла, в целом электронейтрального. Этим объясняется отсутствие пространственной направленности металлической связи и высокие координационные числа металлических структур. Это означает, что металлическая связь не проявляет свойств насыщаемости, столь характерных для ковалентной связи. Делокализация же валентных электронов в металлах является следствием многоцентрового характера металлической связи и причиной хорошей электро- и теплопроводности металлов, пластичности и ковкости. Для веществ с ковалентной связью при отсутствии примесей электропроводность может быть обеспечена только в результате разрушения этих связей. Объясняется это тем, что ковалентная связь соединяет только два соседних атома, а общие электроны пребывают в непосредственной близости от них и прочно с ними связаны.
Металлическая связь – многоцентровая химическая связь с дефицитом электронов, основанная на обобществлении внешних электронов атомов. Таким образом, металлическая связь характерна только для конденсированного состояния вещества. В паро- и газообразном состоянии атомы всех веществ, в том числе и металлов, связаны между собой только ковалентной связью.
Аналогия между ковалентной и металлической связями подтверждается распределением электронной плотности между атомными остовами. Для обоих типов связей в пространстве между атомными остовами сохраняется значительная электронная плотность, образуя электронные мостики между взаимодействующими атомами.
Разница заключается в том, что в ковалентной связи электронные мостики имеют строго определенное пространственное направление, а у металлической связи электронная плотность равномерно распределена по всем направлениям. В результате в решетке типичных металлов все атомы кристаллографически эквивалентны и эффективные заряды атомов равны нулю.
 2014-02-18
2014-02-18 2029
2029
