Полярные и неполярные молекулы
Различают две разновидности ковалентной связи: неполярную и полярную. В случае неполярной ковалентной связи электронное облако, образованное общей парой электронов, или электронное облако связи, распределяется в пространстве симметрично относительно обоих атомов. Примером являются двухатомные молекулы, состоящие из атомов одного элемента: H2, Cl2, O2, N2, F2 и другие, в которых электронная пара в одинаковой мере принадлежит обоим атомам. В случае полярной ковалентной связи электронное облако связи смещено к атому с большей относительной электроотрицательностью. Примером могут служить молекулы летучих неорганических соединений: HCl, H2O, H2S, NH3 и другие.
| Н 2,1 | ||||||
| Li 1,0 | Be 1,5 | B 2,0 | C 2,5 | N 3,0 | O 3,5 | F 4,0 |
| Na 0,9 | Mg 1,2 | Al 1,5 | Si 1,8 | P 2,1 | S 2,5 | Cl 3,0 |
| K 0,8 | Ca 1,0 | Ga 1,6 | Ge 1,8 | As 2,0 | Se 2,4 | Br 2,8 |
| Rb 0,8 | Sr 1,0 | In 1,7 | Sn 1,8 | Sb 1,9 | Te 2,1 | J 2,5 |
Электрические центры положительных и отрицательных зарядов в молекуле не совпадают в одной точке, а находятся на некотором расстоянии ℓ.
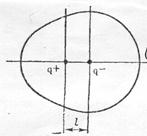
Полярная молекула с постоянным электрическим моментом диполя
Молекула при общей нейтральности представляет собой электрический диполь с зарядом q- – у атома хлора и q+ - у атома водорода. Такие связи и молекулы называются полярными. Заряды атомов в молекуле q называются эффективными зарядами (в молекуле HCl qcl = -0,18; а qн = +0,18 абсолютного заряда электрона, степень ионности связи
18 %).
Мера полярности связи и молекулы – электрический момент диполя (μ – «мю») определяется произведением
μ = qℓ, Кл∙м или μ = qℓ/3,33∙10-30, Д
где q – эффективный заряд; ℓ - длина диполя. Единица электрического момента диполя (система СИ) выражается значением 3,33∙10-30 Кл∙м (кулон-метр) = 1Д (Д - Дебай).
Электрический момент диполя – векторная величина. Направление его условно принимают от положительного заряда к отрицательному – в сторону смещения связующего электронного облака. Чем больше разность электроотрицательностей элементов в полярных молекулах, тем больше электрический момент диполя.
Для многоатомных молекул следует различать понятия о дипольных моментах отдельных связей и молекулы в целом. Поскольку при наличии нескольких связей в молекуле их дипольные моменты складываются по правилу параллелограмма, то в зависимости от формы молекулы, определяемой направленностью связей, результирующий дипольный момент отличается от дипольных моментов отдельных связей и в частном случае (для высокосимметричных молекул) может быть равен нулю, несмотря на значительную полярность отдельных связей. Например, линейная молекула СО2 неполярна (μ = 0), хотя каждая связь С=О имеет значительный дипольный момент (μ = 2,7 Д).
-δ +2δ -δ
О == С == О
2,7 Д 2,7 Д
Молекулы, содержащие неполярную ковалентную связь, называются неполярными или гомеополярными. У таких молекул связующее электронное облако распределяется симметрично между ядрами обоих атомов, и ядра в равной мере действуют на него. Примером могут служить молекулы простых веществ, состоящие из атомов одного элемента: H2, Cl2, O2, N2, F2 и другие. Электрический момент диполя таких молекул равен нулю.
Способность молекул (и отдельных связей) поляризоваться под влиянием внешнего электрического поля называется поляризуемостью. Это может происходить и под влиянием поля, создаваемого приблизившейся полярной молекулой. Поэтому поляризуемость имеет большое значение в химических реакциях.
Всегда важно учитывать полярность молекулы и ее электрический момент диполя. С последним связана реакционная способность веществ. Как правило, чем больше электрический момент диполя молекулы, тем выше реакционная способность вещества. С электрическим моментом диполя связана также и растворимость веществ. Полярные молекулы жидкостей благоприятствуют электрической диссоциации растворенных в них электролитов по принципу «подобное растворяется в подобном».
 2014-02-18
2014-02-18 1966
1966
