Из двух и более компонентов
Равновесие в гетерогенных системах, состоящих
Рассмотрим двухкомпонентную систему.
Обозначения:
индекс 1 – растворитель;
индекс 2 – растворенное вещество;
х 1, х 2 – мольные доли растворителя и растворенного вещества в растворе,
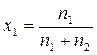 ,
, 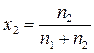 ,
,
х 1 + х 2 = 1.
1. Растворы нелетучих веществ.
 Состав раствора – х 1, х 2.
Состав раствора – х 1, х 2.
Поскольку растворенное вещество нелетучее, паровая фаза будет представлена только растворителем, р 1 – давление насыщенного пара растворителя над раствором.
При равновесии химический потенциал растворителя одинаков в обеих фазах – жидкой и паровой:
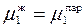 .
.
В случае разбавленных растворов давление насыщенного пара растворителя над раствором нелетучего вещества рассчитывается по формуле:
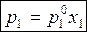 , (6)
, (6)
где 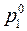 – давление насыщенного пара чистого растворителя при температуре раствора.
– давление насыщенного пара чистого растворителя при температуре раствора.
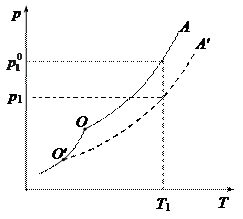 Поскольку х 1 < 1, следовательно,
Поскольку х 1 < 1, следовательно, 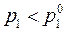 , т.е. при растворении в данном растворителе какого-либо вещества равновесное давление пара растворителя понижается (кривая О'А').
, т.е. при растворении в данном растворителе какого-либо вещества равновесное давление пара растворителя понижается (кривая О'А').
Преобразуем уравнение (6), выразив мольную долю растворителя х 1 через мольную долю растворенного вещества х 2:
х 1 = 1 – х 2,
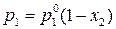 ,
,
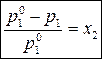 . (7)
. (7)
Уравнение (7) выражает закон Рауля: относительное понижение давления насыщенного пара растворителя над разбавленным раствором нелетучего вещества равно мольной доле растворенного вещества.
 2. Растворы взаиморастворимых летучих жидкостей.
2. Растворы взаиморастворимых летучих жидкостей.
В паровой фазе будут присутствовать оба компонента;.
р 1, р 2 – их равновесные парциальные давления.
Условно примем, что растворителем является жидкость с более высокой температурой кипения (высококипящий компонент):
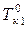 – температура кипения чистого растворителя;
– температура кипения чистого растворителя;
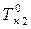 – температура кипения чистого растворенного вещества;
– температура кипения чистого растворенного вещества;
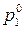 ,
, 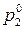 – давление насыщенного пара чистого растворителя и чистого растворенного вещества соответственно.
– давление насыщенного пара чистого растворителя и чистого растворенного вещества соответственно.
Поскольку 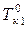 >
> 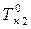 , следовательно,
, следовательно, 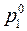 <
< 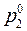 , т.е., чем выше температура кипения вещества, тем ниже давление насыщенного пара над ним, а пар над раствором всегда обогащен низкокипящим компонентом.
, т.е., чем выше температура кипения вещества, тем ниже давление насыщенного пара над ним, а пар над раствором всегда обогащен низкокипящим компонентом.
Равновесные парциальные давления растворителя и растворенного вещества над идеальным раствором рассчитывают по формулам:
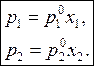
По закону Дальтона общее давление пара над раствором двух летучих жидкостей равно сумме парциальных давлений каждого компонента:
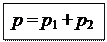
Как было показано, состав пара отличается от состава жидкой фазы. Применяя к парам законы идеальных газов (что допустимо при не слишком высоких давлениях), можно из парциальных давлений пара компонентов рассчитать состав пара и, таким образом, установить связь между составами жидкости и пара.
Обозначим y 1, y 2 – мольные доли растворителя и растворенного вещества в паровой фазе.
Учитывая, что парциальное давление i-го компонента равно
pi = yip,
для двухкомпонентной системы можно записать:
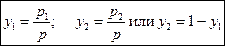 .
.
 2014-02-18
2014-02-18 1324
1324






