Основное уравнение кинетической теории газов (уравнение Клаузиуса).
Основное уравнение молекулярно кинетической теории связывает параметры состояния газа с характеристиками движения молекул.
Для вывода уравнения используется статистический метод, то есть зная характеристики отдельных молекул газа 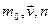 (концентрация) можно найти
(концентрация) можно найти 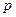 - давление газа, характеристику всего газа.
- давление газа, характеристику всего газа.
Для вывода уравнения рассмотрим одноатомный идеальный газ. Молекулы движутся хаотически. Скорости молекул разные. Предположим, что число взаимных столкновений между молекулами газа пренебрежимо мало по сравнению с числом ударов о стенки сосуда, соударения молекул со стенками сосуда абсолютно упруги. Найдем давление на стенки сосуда, предположив, что газ находится в сосуде кубической формы с ребром 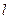 . Давление ищем как усредненный результат ударов молекул газа о стенки сосуда.
. Давление ищем как усредненный результат ударов молекул газа о стенки сосуда.
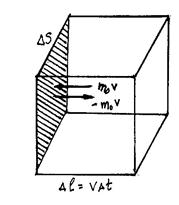
| 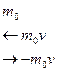 Изменение импульса молекулы за счет столкновения со стенкой равно
Изменение импульса молекулы за счет столкновения со стенкой равно
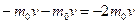 . .
|
1). По третьему закону Ньютона стенка получает импульс от каждой молекулы 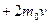
2). За время 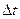 площадки
площадки 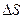 достигают только те молекулы, которые заключены в объеме
достигают только те молекулы, которые заключены в объеме
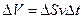
3). Число этих молекул в объеме 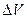 равно
равно
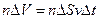 .
.
4). Число ударов о площадку равно 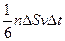 .
.
5). При столкновении молекулы передают площадке импульс
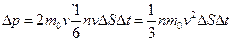
Учитывая, что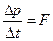 - сила, а
- сила, а 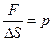 - давление,
- давление,
имеем для давления
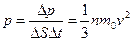 (1)
(1)
Если в объеме газ содержит 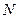 молекул, которые движутся со скоростями
молекул, которые движутся со скоростями 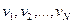 , то надо ввести понятие о среднеквадратичной скорости по формуле
, то надо ввести понятие о среднеквадратичной скорости по формуле
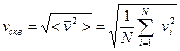 . (2)
. (2)
Тогда выражение (1) примет вид
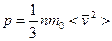 =
= 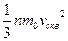
- Основное уравнение кинетической теории газов.
Это уравнение можно преобразовать, замечая, что
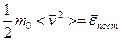 .
.
Тогда
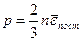 .
.
С другой стороны
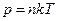 .
.
Поэтому
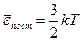 .
.
Средняя кинетическая энергия хаотического движения молекул прямо пропорциональна температуре и не зависит от массы. При Т=0 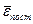 = 0, движение молекул газа прекращается и давление равно нулю.
= 0, движение молекул газа прекращается и давление равно нулю.
Абсолютная температура, Т – это мера средней кинетической энергии поступательного движения молекул идеального газа. Но это верно лишь при умеренных температурах, пока нет распада или ионизации молекул и атомов. Если число частиц в системе мало, то это тоже неверно, так как нельзя ввести понятие средней квадратичной скорости.
Из 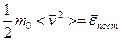 и
и 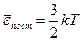 следует
следует
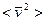 =
= 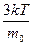 .
.
Лекция 12
Первый закон термодинамики.
Термодинамика – наука о свойствах и взаимопревращениях энергии. В основе этой науки лежат два закона: Первый закон представляет закон сохранения энергии в приложении к процессам взаимного превращения теплоты и работы. Второй закон характеризует направление процессов, происходящих в термодинамических системах.
Под термодинамической системой (ТДС) понимается совокупность макроскопических объектов, обменивающихся энергией в форме работы или тепла друг с другом и с внешней средой.
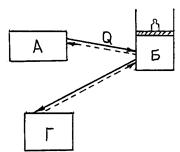
| В ТДС входят (рис.1): источник тепла А, могущий получать или отдавать энергию в виде тепла; рабочее тело Б, преобразующее тепло в работу или наоборот; тело Г, могущее отдавать или аккумулировать работу. Рабочее тело совершает преобразование тепла в работу или обратно. Рабочее тело – движущаяся материальная среда (жидкая или газообразная) играет роль посредника в процессах взаимопревращения тепла и работы. |
| Рис 1. |
В качестве рабочего тела используется воздух, или газ, или продукты сгорания топлив. Для простоты в технической термодинамике в качестве рабочего тела применяется идеальный газ.
Важным свойством идеального газа является отсутствие вязкости, а его термодинамические свойства зависят только от строения молекул. Идеальные газы подразделяются на одноатомные, двух-, трех- и многоатомные.
Состояние идеального газа характеризуется давлением 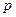 , удельным объемом
, удельным объемом 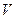 и температурой
и температурой 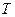 . Давление измеряется барометрами (в области атмосферного давления), манометрами (высокое давление), вакуумметрами (низкое давление). Абсолютное давление равно
. Давление измеряется барометрами (в области атмосферного давления), манометрами (высокое давление), вакуумметрами (низкое давление). Абсолютное давление равно 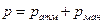 ,
, 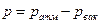 . Оно и используется при термодинамических расчетах.
. Оно и используется при термодинамических расчетах.
Удельный объем – объем единицы массы вещества
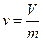 м3/кг.
м3/кг.
Величина, обратная удельному объему называется плотностью
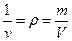 кг/м3.
кг/м3.
Температура характеризует степень нагретости тела, это мера интенсивности теплового движения молекул.
 2014-02-09
2014-02-09 601
601








