В ходе самопроизвольного процесса энергия Гиббса уменьшается до определенной величины, принимая минимально возможное для данной системы значение Gmin. Дальнейшее изменение энергии Гиббса при неизменных условиях становится невозможным, система переходит в состояние химического равновесия. При его наступлении она не может больше совершать полезную работу, поэтому термодинамическим критерием установления равновесия является следующее уравнение:
∆G = 0
Таким образом, любая химическая реакция протекает самопроизвольно только в направлении, приближающем систему к состоянию равновесия. Причем движущей силой данного процесса является изменение изобарно-изотермического потенциала системы ∆G. Чем ∆G меньше, тем дальше система находится от состояния равновесия и тем более она реакционноспособна (Рис.)
Равновесие может существовать только для обратимых реакций
Как следует из рисунка состояние химического равновесия в случае обратимой реакции можно достичь двумя путями: из начального состояния системы, в котором находятся только исходные вещества (точка x на графике), либо из начального состояния системы, в котором находятся только продукты реакции (точка y на графике).
Опытным путем было установлено, что для большинства обратимых реакций в условиях их протекания величина |∆G | как прямой, так и обратной реакции обычно не превышает 10 кДж /моль.
Если же для одной из реакций |∆G | >> 10 кДж /моль, то она становится необратимой по направлению. Следует иметь в виду, что реакции, необратимые в одних условиях, могут стать обратимыми при их изменении.
Многие реакции являются обратимыми в условиях отличных от стандартных. В этом случае для расчета ∆G химической реакции в состоянии равновесия необходимо использовать ∆G образования исходных и конечных веществ именно для этих, а не стандартных условий.
Если реакция осуществляется в газовой фазе, то установлено, что ∆G образования 1 моля газа при его равновесном парциальном давлении p (отличном от 1) равна
∆Gобр = ∆G°298 ∙ RT ln p
Для реакций, протекающих в растворе, ∆G образования вещества рассчитывается аналогично:
∆Gобр = ∆G°298 ∙ RT ln C
где C – равновесная молярная концентрация растворенного вещества
Рассмотрим обратимую химическую реакцию, протекающую в газовой фазе
aA + bB ↔ cC + dD
Как известно ∆G химической реакции равно сумме ∆G образования продуктов реакции за вычетом суммы ∆G образования исходных веществ (с учетом их стехиометрических коэффициентов)
∆Gх.р. = с ∆Gобр.С + d ∆Gобр.D – a ∆Gобр.A – b ∆Gобр.B =
= с ∆G°298С + с RT ln pС + d ∆G°298D + d RT ln pD – a ∆G°298A – a RT ln pA – b ∆G°298B – b RT ln pB;
Данное уравнение можно преобразовать
∆Gх.р. = с ∆G°298С + d ∆G°298D – a ∆G°298A – b ∆G°298B + с RT ln pС + d RT ln pD – a RT ln pA – b RT ln pB;
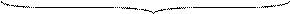 |
∆G°298 х.р.
В окончательном варианте его можно записать таким образом
∆Gх.р. = ∆G°298 х.р. + RT ln 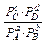
Так как при равновесии ∆Gх.р. = 0, то
∆G°298 х.р. = - RT ln 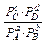
Где PA, PB, PC, и PD являются равновесными парциальными давлениями веществ A, B, C и D.
Как следует из последнего уравнения, выражение под знаком логарифма есть величина постоянная, при данной температуре T. Она называется иначе константой химического равновесия Kравн.
Таким образом, для изобарно-изотермических условий
∆G°298 х.р. = - RT ln Kравн.
Рассуждая подобным образом для этой же реакции aA + bB ↔ cC + dD, но уже протекающей в растворе, можем вывести аналогичное уравнение
∆G°298 х.р. = - RT ln 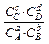
В этом случае Kравн. = 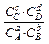
где СA, СB, СC, и СD – равновесные молярные концентрации исходных и конечных веществ.
Организм взрослого человека характеризуется относительным постоянством многих параметров, в том числе различных биохимических показателей, включающих в себя концентрации биологически активных веществ. Однако такое состояние нельзя назвать равновесным, т.к. оно не приложимо к открытым системам. Организм человека как любая живая система, постоянно обменивается с окружающей средой различными веществами: потребляет продукты питания и выделяет продукты их окисления и распада. Следовательно для организма характерно стационарное состояние, определяемое как постоянство его параметров при постоянной скорости обмена с окружающей средой веществом и энергией. В первом приближении стационарное состояние можно рассматривать как ряд равновесных состояний, связанных между собой процессами релаксации. В состоянии равновесия концентрации веществ, участвующих в реакции поддерживаются за счёт восполнения извне исходных и удалениия наружу конечных продуктов. Изменение их содержания в организме не приводит в отличие от закрытых систем к новому термодинамическому равновесию. Система возвращается в первоначальное состояние. Таким образом, поддерживается относительное динамическое постоянство состава и свойств внутренней среды организма, обусловливающее устойчивость его физиологических функций. Данное свойство живой системы живой системы называется иначе гомеостазом. В ходе жизнедеятельности организма, находящегося в стационарном состоянии, в отличие от закрытой равновесной системы, происходит увеличение энтропии. Однако наряду с этим одновременно протекает и обратный процесс – уменьшение энтропии за счёт потребления из окружающей среды питательных веществ с низким значением энтропии (например, высокомолекулярных соединений – белков, полисахаридов, углеводов и др.) и выделения в среду продуктов распада. Согласно положению И. Пригожина суммарное производство энтропии для организма находящегося в стационарном состоянии, стремится к минимуму.
Установлено, что энтропия в таких системах возрастает в период эмбриогенеза, при процессах регенерации и росте злокачественных новообразований.
 2014-02-09
2014-02-09 884
884







